


БНБ
"БСЭ" (95279)
- Photogallery
- Естественные науки - Математика - Технология
- Авиация и машиностроение
- Высокие технологии
- Вычислительная техника
- Нанотехнология
- Роботехника
- Энергетика
- Электроника
Бром
Определение "Бром" в Большой Советской Энциклопедии
Бром (лат. Bromum), Br, химический элемент VII группы периодической системы Менделеева, относится к галогенам; атомный номер 35, атомная масса 79,904; красно-бурая жидкость с сильным неприятным запахом. Бром открыт в 1826 французским химиком А. Ж. Баларом при изучении рассолов средиземноморских соляных промыслов; назван от греческого bromos — зловоние. Природный Бром состоит из 2 стабильных изотопов 79Br (50,54%) и 81Вг (49,46%). Из искусственно полученных радиоактивных изотопов Бром наиболее интересен 80Br, на примере которого И. В. Курчатовым открыто явление изомерии атомных ядер.
Нахождение в природе. Содержание Бром в земной коре (1,6·10-4% по массе) оценивается в 1015—1016 т. В главной своей массе Бром находится в рассеянном состоянии в магматических породах, а также в широко распространённых галогенидах. Бром — постоянный спутник хлора. Бромистые соли (NaBr, KBr, MgBr2) встречаются в отложениях хлористых солей (в поваренной соли до 0,03% Br, в калийных солях — сильвине и карналлите — до 0,3% Br), а также в морской воде (0,065% Br), рапе соляных озёр (до 0,2% Br) и подземных рассолах, обычно связанных с соляными и нефтяными месторождениями (до 0,1% Br). Благодаря хорошей растворимости в воде бромистые соли накопляются в остаточных рассолах морских и озёрных водоёмов. Бром мигрирует в виде легко растворимых соединений, очень редко образуя твёрдые минеральные формы, представленные бромиритом AgBr, эмболитом Ag (Cl, Br) и иодэмболитом Ag (Cl, Br, I). Образование минералов происходит в зонах окисления сульфидных серебросодержащих месторождений, формирующихся в засушливых пустынных областях. См. также Бромиды природные.
Физические и химические свойства. При —7,2°С жидкий Бром застывает, превращаясь в красно-коричневые игольчатые кристаллы со слабым металлическим блеском. Пары Бром жёлто-бурого цвета, tkип 58,78°С. Плотность жидкого Бром (при 20°С) 3,1 г/см3. В воде Бром растворим ограниченно, но лучше других галогенов (3,58 г Бром в 100 г H2O при 20°С). Ниже 5,84°С из воды осаждаются гранатово-красные кристаллы Br2·8H2O. Особенно хорошо растворим Бром во многих органических растворителях, чем пользуются для извлечения его из водных растворов. Бром в твёрдом, жидком и газообразном состоянии состоит из 2-атомных молекул. Заметная диссоциация на атомы начинается при температуре около 800 °С; диссоциация наблюдается и при действии света.
Конфигурация внешних электронов атома Бром 4s24p5 Валентность Бром в соединениях переменна, степень окисления равна — 1 (в бромидах, например KBr), + 1 (в гипобромитах, NaBrO), + 3 (в бромитах, NaBrO4), + 5 (в броматах, KBrO3) и + 7 (в перброматах, NaBrO4). Химически Бром весьма активен, занимая по реакционной способности место между хлором и йодом. Взаимодействие Бром с серой, селеном, теллуром, фосфором, мышьяком и сурьмой сопровождается сильным разогреванием, иногда даже появлением пламени. Так же энергично Бром реагирует с некоторыми металлами, например калием и алюминием. Однако многие металлы реагируют с безводным Бром с трудом из-за образования на их поверхности защитной плёнки бромида, нерастворимого в Бром Из металлов наиболее устойчивы к действию Бром, даже при повышенных температурах и в присутствии влаги, серебро, свинец, платина и тантал (золото, в отличие от платины, энергично реагирует с Бром). С кислородом, азотом и углеродом Бром непосредственно не соединяется даже при повышенных температурах. Соединения Бром с этими элементами получают косвенным путём. Таковы крайне непрочные окислы Br2O, BrO2 и Br3O8 (последний получают, например, действием озона на Бром при 80°С). С галогенами Бром взаимодействует непосредственно, образуя BrF3, BrF5, BrCl, IBr и др. (см. Межгалогенные соединения).
Бром — сильный окислитель. Так, он окисляет сульфиты и тиосульфаты в водных растворах до сульфатов, нитриты до нитратов, аммиак до свободного азота (3Вr2 + 8MH3 = N2 + 6NH4Br). Бром вытесняет йод из его соединений, но сам вытесняется хлором и фтором. Свободный Бром выделяется из водных растворов бромидов также под действием сильных окислителей (KMnO4, K2Cr2O7) в кислой среде. При растворении в воде Бром частично реагирует с ней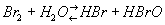
с образованием бромистоводородной кислоты HBr и неустойчивой бромноватистой кислоты HBrO. Раствор Бром в воде называется бромной водой. При растворении Бром в растворах щелочей на холоду происходит образование бромида и гипобромита (2NaOH + Br2 = NaBr + NaBrO + H2O), а при повышенных температурах (около 100°С) — бромида и бромата (6NaOH + 3Br2 = 5NaBr + NaBrO3 + ЗН2О). Из реакций Бром с органическими соединениями наиболее характерны присоединение по двойной связи С=С, а также замещение водорода (обычно при действии катализаторов или света).
Получение и применение. Исходным сырьём для получения Бром служат морская вода, озёрные и подземные рассолы и щелока калийного производства, содержащие Бром в виде бромид-иона Br- (от 65 г/м3 в морской воде до 3—4 кг/м3 и выше в щелоках калийного производства). Бром выделяют при помощи хлора (2Вг- + Cl2 = Br2 + 2С1-) и отгоняют из раствора водяным паром или воздухом. Отгонку паром ведут в колоннах, изготовленных из гранита, керамики или иного стойкого к Бром материала. Сверху в колонну подают подогретый рассол, а снизу — хлор и водяной пар. Пары Бром, выходящие из колонны, конденсируют в керамиковых холодильниках. Далее Бром отделяют от воды и очищают от примеси хлора дистилляцией. Отгонка воздухом позволяет использовать для получения Бром рассолы с его низким содержанием, выделять Бром из которых паровым способом в результате большого расхода пара невыгодно. Из получаемой бромовоздушной смеси Бром улавливают химическими поглотителями. Для этого применяют растворы бромистого железа (2 FeBr2 + Br2 = 2FeBr3), которое, в свою очередь, получают восстановлением FeBr3 железными стружками, а также растворы гидроокисей или карбонатов натрия или газообразный сернистый ангидрид, реагирующий с Бром в присутствии паров воды с образованием бромистоводородной и серной кислот (Br2 + 3O2 + 2H2O = 2HBr + H2SO4). Из полученных полупродуктов Бром выделяют действием хлора (из FeBr3 и HBr) или кислоты (5NaBr + NaBrO3 + 3Н2SO4 = 3Вr2 + 3Na2SO4 + 3Н2О). В случае необходимости полупродукты перерабатывают на бромистые соединения, не выделяя элементарного Бром
Вдыхание паров Бром при содержании их в воздухе 1 мг/м3 и более вызывает кашель, насморк, носовое кровотечение, головокружение, головную боль; при более высоких концентрациях — удушье, бронхит, иногда смерть. Предельно допустимые концентрации паров Бром в воздухе 2 мг/м3. Жидкий Бром действует на кожу, вызывая плохо заживающие ожоги. Работы с Бром следует проводить в вытяжных шкафах. При отравлении парами Бром рекомендуется вдыхать аммиак, используя для этой цели сильно разбавленный раствор его в воде или в этиловом спирте. Боль в горле, вызванную вдыханием паров Бром, устраняют приёмом внутрь горячего молока. Бром, попавший на кожу, смывают большим количеством воды или сдувают сильной струей воздуха. Обожжённые места смазывают ланолином.
Бром применяют довольно широко. Он — исходный продукт для получения ряда бромистых солей и органических производных. Большие количества Бром расходуют для получения бромистого этила и ди-бромэтана — составных частей этиловой жидкости, добавляемой к бензинам для повышения их детонационной стойкости (см. Антидетонаторы). Соединения Бром применяют в фотографии, при производстве ряда красителей, бромистый метил и некоторые другие соединения Бром — как инсектициды. Некоторые органические соединения Бром служат эффективными огнетушащими средствами. Бром и бромную воду используют при химических анализах для определения многих веществ. В медицине используют бромиды натрия, калия, аммония, а также органические соединения Бром, которые применяют при неврозах, истерии, повышенной раздражительности, бессоннице, гипертонической болезни, эпилепсии и хорее.
Лит.: Ксензенко В. И., Стасиневич Д. С., Технология брома и йода, М., 1960; Позин М. Е., Технология минеральных солей, 2 изд., Л., 1961; Bromine and its compounds, ed. Z. Е. Jolles, L., 1966.
В. К. Бельский, Д. С. Стасиневич.
Бром в организме. Бром — постоянная составная часть тканей животных и растений. Наземные растения содержат в среднем 7·10-4% Бром на сырое вещество, животные ~1·10-4%/ Бром найден в различных секретах (слезах, слюне, поте, молоке, желчи). В крови здорового человека содержание Бром колеблется от 0,11 до 2,00 мг%. С помощью радиоактивного Бром (82Br) установлено избирательное поглощение его щитовидной железой, мозговым слоем почек и гипофизом. Введённые в организм животных и человека бромиды усиливают концентрацию процессов торможения в коре головного мозга, содействуют нормализации состояния нервной системы, пострадавшей от перенапряжения тормозного процесса. Одновременно, задерживаясь в щитовидной железе, Бром вступает в конкурентные отношения с йодом, что влияет на деятельность железы, а в связи с этим — и на состояние обмена веществ.
Лит.: Войнар А. И., Биологическая роль микроэлементов в организме животных и человека, 2 изд., М., 1960; Верховская И. Н., Бром в животном организме и механизм его действия, М., 1962.
В. В. Ковальский.
| "БСЭ" >> "Б" >> "БР" >> "БРО" >> "БРОМ" |
Статья про "Бром" в Большой Советской Энциклопедии была прочитана 682 раз
| Бургер двойного помола |
| Салат с Кальмарами |
TOP 20
- Лемке Михаил Константинович
- Сульфгидрильные группы
- «Казарменный коммунизм»
- Японское море
- Периодическая система элементов
- Глициния
- Башкирская Автономная Советская Социалистическая Республика
- Иммунитет (историч.)
- Андаманское море
- Объединённая партия гаитянских коммунистов
- Сенсуализм
- «Сообразительный»
- Балкано-кавказская раса
- Навигация (морск.)
- Звёздная астрономия
- Ямполь (пос. гор. типа в Донецкой обл.)
- Мандельштама - Бриллюэна рассеяние
- Кульчицкая Елена Львовна
- Театральные учебные заведения
- Электрическая постоянная