


БНБ
"БСЭ" (95279)
- Photogallery
- Естественные науки - Математика - Технология
- Авиация и машиностроение
- Высокие технологии
- Вычислительная техника
- Нанотехнология
- Роботехника
- Энергетика
- Электроника
Гесса закон
Определение "Гесса закон" в Большой Советской Энциклопедии
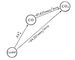 |
| Закон Гесса (схема) |
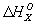 ккал/моль) из графита можно рассчитать, зная, что теплоты сгорания
ккал/моль) из графита можно рассчитать, зная, что теплоты сгорания 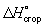 окиси углерода и графита до CO2 при этой температуре равны соответственно —282,99 и —393,32 кдж/моль (—67,635 и—94,051 ккал/моль). Рассматривая два пути образования CO2 из графита при непосредственном сжигании его до CO2 и при промежуточном образовании СО (см. рис.) и зная, что по Гесса закон общий тепловой эффект обоих путей перехода должен быть одинаковым, находим
окиси углерода и графита до CO2 при этой температуре равны соответственно —282,99 и —393,32 кдж/моль (—67,635 и—94,051 ккал/моль). Рассматривая два пути образования CO2 из графита при непосредственном сжигании его до CO2 и при промежуточном образовании СО (см. рис.) и зная, что по Гесса закон общий тепловой эффект обоих путей перехода должен быть одинаковым, находим 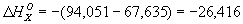 ккал/моль (теплота выделяется).
ккал/моль (теплота выделяется).В. А. Киреев.
| "БСЭ" >> "Г" >> "ГЕ" >> "ГЕС" |
Статья про "Гесса закон" в Большой Советской Энциклопедии была прочитана 934 раз
| Бургер двойного помола |
| Кишки на гриле |
TOP 20
- Лемке Михаил Константинович
- Сульфгидрильные группы
- «Казарменный коммунизм»
- Японское море
- Периодическая система элементов
- Глициния
- Башкирская Автономная Советская Социалистическая Республика
- Иммунитет (историч.)
- Андаманское море
- Сенсуализм
- Объединённая партия гаитянских коммунистов
- «Сообразительный»
- Балкано-кавказская раса
- Навигация (морск.)
- Звёздная астрономия
- Ямполь (пос. гор. типа в Донецкой обл.)
- Мандельштама - Бриллюэна рассеяние
- Кульчицкая Елена Львовна
- Театральные учебные заведения
- Электрическая постоянная