


БНБ
"БСЭ" (95279)
- Photogallery
- Естественные науки - Математика - Технология
- Авиация и машиностроение
- Высокие технологии
- Вычислительная техника
- Нанотехнология
- Роботехника
- Энергетика
- Электроника
Аммиак
Определение "Аммиак" в Большой Советской Энциклопедии
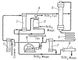 |
| Агрегат синтеза аммиака (схема) |
Физические и химические свойства. Аммиак — бесцветный газ с резким удушливым запахом и едким вкусом. Плотность газообразного Аммиак при 0°С и 101,3 кн/м2 (760 мм рт. ст.) 0,7714 кг/м3, tкип —33,35°С, tпл —77,70°С, tкpит 132,4°С, давление критическое 11,28 Мн/м2 (115,0 кгс/см2), плотность критическая 235 кг/м3, теплота испарения 23,37 кдж/моль (5,581 ккал/моль). Сухая смесь Аммиак с воздухом способна взрываться; границы взрывчатости при комнатной температуре лежат в пределах 15,5—28% Аммиак, с повышением температуры границы расширяются. Аммиак хорошо растворим в воде (при 0°С объём воды поглощает около 1200 объёмов Аммиак, при 20 °С — около 700 объёмов Аммиак). При 20°С и 0,87 Мн/м2 (8,9 кгс/см2) Аммиак легко переходит в бесцветную жидкость с плотностью 681,4 кг/м3, сильно преломляющую свет. Подобно воде, жидкий Аммиак сильно ассоциирован, главным образом за счёт образования водородных связей. Жидкий Аммиак практически не проводит электрический ток. Жидкий Аммиак — хороший растворитель для очень большого числа органических, а также для многих неорганических соединений. Твёрдый Аммиак — бесцветные кубические кристаллы.
Молекула Аммиак имеет форму правильной тригонометрической пирамиды с атомом N в вершине; углы между связями H—N—H 108°, межатомные расстояния H—N—H 1,015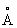 , H—H 1,64
, H—H 1,64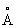 .
.
Интересным свойством молекул Аммиак является их способность к структурной инверсии, т. е. к «выворачиванию наизнанку» путём прохождения атома азота сквозь образованную атомами водорода плоскость основания пирамиды. Инверсия связана с излучением строго определённой частоты, на основе чего была создана аппаратура для очень точного определения времени (молекулярные генераторы). Такие «молекулярные часы» позволили, в частности, установить, что продолжительность земных суток ежегодно возрастает на 0,43 мсек. Дипольный момент молекулы Аммиак равен 1,43D. Благодаря отсутствию неспаренных электронов Аммиак диамагнитен.
Аммиак — весьма реакционноспособное соединение. За счёт наличия неподелённой электронной пары у атома N особенно характерны и легко осуществимы для Аммиак реакции присоединения. Наиболее важна реакция присоединения протона к молекуле Аммиак, ведущая к образованию иона аммония NH+4, который в соединениях с анионами кислот ведёт себя подобно ионам щелочных металлов. Такие реакции происходят при растворении Аммиак в воде с образованием слабого основания — аммония гидроокиси NH4OH, а также при непосредственном взаимодействии Аммиак с кислотами. Распространённый тип реакций присоединения — образование аммиакатов при действии газообразного или жидкого Аммиак на соли. Для Аммиак характерны также реакции замещения. Щелочные и щёлочноземельные металлы реагируют с жидким и газообразным Аммиак, образуя в зависимости от условий нитриды (Na3N) или амиды (NaNH2). Аммиак реагирует также с серой, галогенами, углем, CO2 и др. К окислителям в обычных условиях Аммиак довольно устойчив, однако, будучи подожжён, он горит в атмосфере кислорода, образуя воду и свободный азот. Каталитическим окислением Аммиак получают окись азота, превращаемую затем в азотную кислоту.
Получение и применение. В лабораторных условиях Аммиак может быть получен вытеснением его сильными щелочами из аммониевых солей по схеме: 2NH4CI + Ca(OH)2 = 2NH3 + CaCl2 + 2H2O. Старейший промышленный способ получения Аммиак — выделение его из отходящих газов при коксовании угля. Основной современный способ промышленного получения Аммиак — синтез из элементов — азота и водорода, предложенный в 1908 немецким химиком Ф. Габером.
Наиболее распространённым и экономичным методом получения технологического газа для синтеза Аммиак является конверсия углеводородных газов. Исходным сырьём в этом процессе служит природный газ, а также попутные нефтяные газы, газы нефтепереработки, остаточные газы производства ацетилена. Сущность конверсионного метода получения азото- href="http://H-Hydrogen.info/">водородной смеси состоит в разложении при высокой температуре метана и его гомологов на водород и окись углерода с помощью окислителей — водяного пара и кислорода. К конвертированному газу при этом добавляют атмосферный воздух или воздух, обогащенный кислородом. Синтез Аммиак из простых веществ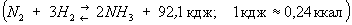
протекает с выделением тепла и уменьшением объёма. Наиболее благоприятными, с точки зрения равновесия, условиями образования Аммиак являются возможно более низкая температура и возможно более высокое давление. Без катализаторов реакция синтеза Аммиак вообще не происходит. В промышленности для синтеза Аммиак используют исключительно железные катализаторы, получаемые восстановлением сплавленных окислов железа Fe3O4 с активаторами (Al2O3, K2O, CaO, SiO2, а иногда и MgO). Важный этап процесса синтеза — очистка газовой смеси от каталитических ядов (к ним относятся вещества, содержащие S, O2, Se, P, As, пары воды, CO и др.).
Способы производства синтетического Аммиак различаются по применяемому давлению: системы низкого (10—15 Мн/м2), среднего (25—30 Мн/м2) и высокого (50—100 Мк/л2) давления. Наиболее распространены системы среднего давления (30 Мн/м2 и 500°С) (1 Мн/м2(10 кгс/см2). Для увеличения степени использования газа в современных системах синтеза Аммиак применяют многократную циркуляцию азото- href="http://H-Hydrogen.info/">водородной смеси — круговой аммиачный цикл (см. рис.).
Свежий газ (азото- href="http://H-Hydrogen.info/">водородная смесь) и непрореагировавшие, т. н. циркуляционные газы поступают сначала в фильтр 1, где они очищаются от посторонних примесей, затем в межтрубное пространство конденсационной колонны 2, отдавая своё тепло газу, движущемуся по трубкам колонны. Далее газы проходят через испаритель 3, в котором происходят их дальнейшее охлаждение и конденсация Аммиак, увлечённого циркуляционными газами. Охлажденная смесь газов и сконденсировавшийся Аммиак из испарителя направляются в разделительную часть (сепаратор) конденсационной колонны, где жидкий Аммиак отделяется и как готовый продукт выводится по трубе в резервуар 9. Газообразный Аммиак, выходящий из испарителя, проходя брызгоуловитель 4, освобождается от капель жидкого Аммиак и направляется в цех переработки или в холодильную установку на сжижение. Газы, освобожденные от Аммиак, из сепаратора поступают в колонну синтеза 5. Колонна синтеза внутри имеет катализаторную коробку с трубчатой или полочной насадкой и теплообменник. Газы, проходя через колонну синтеза, реагируют между собой; выходящая из колонны газовая смесь содержит 15 — 20% Аммиак Далее эти газы поступают в конденсатор 6, где и происходит сжижение Аммиак Жидкий Аммиак отделяется в сепараторе 7 и поступает в резервуар 9, а непрореагировавшие газы подаются циркуляционным насосом 8 в фильтр 1 для смешения со свежей азото- href="http://H-Hydrogen.info/">водородной смесью.
Аммиак используется для получения азотной кислоты, азотсодержащих солей, мочевины, синильной кислоты, соды по аммиачному методу. Так как жидкий Аммиак имеет большую теплоту испарения, то. он служит рабочим веществом холодильных машин. Жидкий Аммиак и его водные растворы применяют как жидкие удобрения. Большие количества Аммиак идут на аммонизацию суперфосфата и туковых смесей.
Аммиак ядовит. Он сильно раздражает слизистые оболочки. Острое отравление Аммиак вызывает поражения глаз и дыхательных путей, одышку, воспаление лёгких. Предельно допустимой концентрацией Аммиак в воздухе производственных помещений считается 0,02 г/м3. Аммиак хранят в стальных баллонах, окрашенных в жёлтый цвет, с чёрной надписью — Аммиак
Лит.: Технология связанного азота, М., 1966.
В. К. Бельский.
| "БСЭ" >> "А" >> "АМ" >> "АММ" |
Статья про "Аммиак" в Большой Советской Энциклопедии была прочитана 899 раз
| Чистим кильку легко и просто |
| Куриный суп |
TOP 20
- Лемке Михаил Константинович
- Сульфгидрильные группы
- «Казарменный коммунизм»
- Японское море
- Периодическая система элементов
- Глициния
- Башкирская Автономная Советская Социалистическая Республика
- Иммунитет (историч.)
- Андаманское море
- Сенсуализм
- «Сообразительный»
- Балкано-кавказская раса
- Навигация (морск.)
- Звёздная астрономия
- Ямполь (пос. гор. типа в Донецкой обл.)
- Кульчицкая Елена Львовна
- Мандельштама - Бриллюэна рассеяние
- Театральные учебные заведения
- Электрическая постоянная
- Энсор Джеймс