


БНБ
"БСЭ" (95279)
- Photogallery
- Естественные науки - Математика - Технология
- Авиация и машиностроение
- Высокие технологии
- Вычислительная техника
- Нанотехнология
- Роботехника
- Энергетика
- Электроника
Литий
Определение "Литий" в Большой Советской Энциклопедии
Литий (лат. Lithium), Li, химический элемент 1 группы периодической системы Менделеева, атомный номер 3, атомная масса 6,941, относится к щелочным металлам. Природный Литий состоит из двух стабильных изотопов - 6Li (7,42%) и 7Li (92,58%).
Литий был открыт в 1817 шведским химиком А. Арфведсоном в минерале петалите; название от греч. líthos - камень. Металлический Литий впервые получен в 1818 английским химиком Г. Дэви.
Распространение в природе. Литий - типичный элемент земной коры (содержание 3,2×10-3% по массе), он накапливается в наиболее поздних продуктах дифференциации магмы - пегматитах. В мантии мало Литий - в ультраосновных породах всего 5×10-3% (в основных 1,5×10-3%, средних - 2×10-3%, кислых 4×10-3%). Близость ионных радиусов Li+, Fe2+ и Mg2+ позволяет Литий входить в решётки магнезиально-железистых силикатов - пироксенов и амфиболов. В гранитоидах он содержится в виде изоморфной примеси в слюдах. Только в пегматитах и в биосфере известно 28 самостоятельных минералов Литий (силикаты, фосфаты и др.). Все они редкие (см. Литиевые руды). В биосфере Литий мигрирует сравнительно слабо, роль его в живом веществе меньше, чем остальных щелочных металлов. Из вод он легко извлекается глинами, его относительно мало в Мировом океане (1,5×10-5%). Промышленные месторождения Литий связаны как с магматическими породами (пегматиты, пневматолиты), так и с биосферой (солёные озёра).
Физические и химические свойства. Компактный Литий - серебристо-белый металл, быстро покрывающийся тёмно-серым налётом, состоящим из нитрида Li3N и окиси Li2O. При обычной температуре Литий кристаллизуется в кубической объёмноцентрированной решётке, а = 3,5098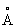 . Атомный радиус 1,57
. Атомный радиус 1,57 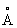 , ионный радиус Li+ 0,68
, ионный радиус Li+ 0,68 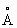 . Ниже -195°С решётка Литий гексагональная плотноупакованная. Литий - самый лёгкий металл; плотность 0,534 г/см3 (20°С); tпл. 180,5°С, tkип. 1317°С. Удельная теплоёмкость (при 0-100°С) 3,31(103 дж/(кг×К), т. е. 0,790 кал/(г·град); термический коэффициент линейного расширения 5,6×10-5. Удельное электрическое сопротивление (20°С) 9,29×10-8 ом·м (9,29 мком·см); температурный коэффициент электрического сопротивления (0-100°С) 4,50×10-3. Литий парамагнитен. Металл весьма пластичен и вязок, хорошо обрабатывается прессованием и прокаткой, легко протягивается в проволоку. Твёрдость по Моосу 0,6 (твёрже, чем Na и К), легко режется ножом. Давление истечения (15-20°С) 17 Мн/м2 (1,7 кгс/мм2). Модуль упругости 5 Гн/м2 (500 кгс/мм2), предел прочности при растяжении 116 Мн/м2 (11,8 кгс/мм2), относительное удлинение 50-70%. Пары Литий окрашивают пламя в карминово-красный цвет.
. Ниже -195°С решётка Литий гексагональная плотноупакованная. Литий - самый лёгкий металл; плотность 0,534 г/см3 (20°С); tпл. 180,5°С, tkип. 1317°С. Удельная теплоёмкость (при 0-100°С) 3,31(103 дж/(кг×К), т. е. 0,790 кал/(г·град); термический коэффициент линейного расширения 5,6×10-5. Удельное электрическое сопротивление (20°С) 9,29×10-8 ом·м (9,29 мком·см); температурный коэффициент электрического сопротивления (0-100°С) 4,50×10-3. Литий парамагнитен. Металл весьма пластичен и вязок, хорошо обрабатывается прессованием и прокаткой, легко протягивается в проволоку. Твёрдость по Моосу 0,6 (твёрже, чем Na и К), легко режется ножом. Давление истечения (15-20°С) 17 Мн/м2 (1,7 кгс/мм2). Модуль упругости 5 Гн/м2 (500 кгс/мм2), предел прочности при растяжении 116 Мн/м2 (11,8 кгс/мм2), относительное удлинение 50-70%. Пары Литий окрашивают пламя в карминово-красный цвет.
Конфигурация внешней электронной оболочки атома Литий 2s1; во всех известных соединениях он одновалентен. При взаимодействии с кислородом или при нагревании на воздухе (горит голубым пламенем) Литий образует окись Li2O (перекись Li2O2 получается только косвенным путём). С водой реагирует менее энергично, чем др. щелочные металлы, при этом образуются гидроокись LiOH и водород. Минеральные кислоты энергично растворяют Li (стоит первым в ряду напряжений, его нормальный электродный потенциал - 3,02 в).
Литий соединяется с галогенами (с йодом при нагревании), образуя галогениды (важнейший - лития хлорид). При нагревании с серой Литий даёт сульфид Li2S, а с водородом - лития гидрид. С азотом Литий медленно реагирует уже при комнатной температуре, энергично - при 250°С с образованием нитрида Li3N. С фосфором Литий непосредственно не взаимодействует, но в специальных условиях могут быть получены фосфиды Li3P, LiP, Li2P2. Нагревание Литий с углеродом приводит к получению карбида Li2C2, с кремнием - силицида Литий Бинарные соединения Литий - Li2O, LiH, Li3N, Li2C2, LiCI и др., a также LiOH весьма реакционноспособны; при нагревании или плавлении они разрушают многие металлы, фарфор, кварц и др. материалы. Карбонат (см. Лития карбонат), фторид LiF, фосфат Li3PO4 и др. соединения Литий по условиям образования и свойствам близки к соответствующим производным магния и кальция.
Литий образует многочисленные литийорганические соединения, что определяет его большую роль в органическом синтезе.
Литий - компонент многих сплавов. С некоторыми металлами (Mg, Zn, Al) он образует твёрдые растворы значительной концентрации, со многими - интерметаллиды (LiAg, LiHg, LiMg2, LiAl и мн. др.). Последние часто весьма тверды и тугоплавки, незначительно изменяются на воздухе; некоторые из них - полупроводники. Изучено более 30 бинарных и ряд тройных систем с участием Литий; соответствующие им сплавы уже нашли применение в технике.
Получение и применение. Соединения Литий получаются в результате гидрометаллургической переработки концентратов - продуктов обогащения литиевых руд. Основной силикатный минерал - сподумен перерабатывают по известковому, сульфатному и сернокислотному методам. В основе первого - разложение сподумена известняком при 1150-1200°С:
Li2O×Al2O3×4SiO2 + 8CaCO3 = Li2OAl2O3 + 4(2CaO×SiO2) + 8CO2.
При выщелачивании спека водой в присутствии избытка извести алюминат Литий разлагается с образованием гидроокиси Литий:
Li2O×Al2O3 + Ca(OH)2 = 2LiOH + CaO×Al2O3.
По сульфатному методу сподумен (и др. алюмосиликаты) спекают с сульфатом калия:
Li2O×Al2O3×4SiO2 + K2SO4 = Li2SO4 + K2O×Al2O3×4SiO2.
Сульфат Литий растворяют в воде и из его раствора содой осаждают карбонат Литий:
Li2SO4 + Na2CO3 = Li2CO3 + Na2SO4.
+ Na2SO4.
По сернокислотному методу также получают сначала раствор сульфата Литий, а затем карбонат Литий; сподумен разлагают серной кислотой при 250-300°С (реакция применима только для b-модификации сподумена):
b-Li2O×Al2O3×4SiO2 + H2SO4 = Li2SO4 + H2O×Al2O3×4SiO2.
Метод используется для переработки руд, необогащённых сподуменом, если содержание в них Li2O не менее 1%. Фосфатные минералы Литий легко разлагаются кислотами, однако по более новым методам их разлагают смесью гипса и извести при 950-1050°С с последующей водной обработкой спеков и осаждением из растворов карбоната Литий
Металлический Литий получают электролизом расплавленной смеси хлоридов Литий и калия при 400-460°С (весовое соотношение компонентов 1:1). Электролизные ванны футеруются магнезитом, алундом, муллитом, тальком, графитом и др. материалами, устойчивыми к расплавленному электролиту; анодом служат графитовые, а катодом - железные стержни. Черновой металлический Литий содержит механические включения и примеси (К, Mg, Ca, Al, Si, Fe, но главным образом Na). Включения удаляются переплавкой, примеси - рафинированием при пониженном давлении. В настоящее время большое внимание уделяется металлотермическим методам получения Литий
Важнейшая область применения Литий - ядерная энергетика. Изотоп 6Li - единственный промышленный источник для производства трития (см. Водород) по реакции: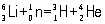 .
.
Сечения захвата тепловых нейтронов (s) изотопами Литий резко различаются: 6Li 945, 7Li 0,033; для естественной смеси 67 (в барнах); это важно в связи с техническим применением Литий - при изготовлении регулирующих стержней в системе защиты реакторов. Жидкий Литий (в виде изотопа 7Li) используется в качестве теплоносителя в урановых реакторах. Расплавленный 7LiF применяется как растворитель соединений U и Th в гомогенных реакторах. Крупнейшим потребителем соединений Литий является силикатная промышленность, в которой используют минералы Литий, LiF, Li2CO3 и многие специально получаемые соединения. В чёрной металлургии Литий, его соединения и сплавы широко применяют для раскисления, легирования и модифицирования многих марок сплавов. В цветной металлургии литием обрабатывают сплавы для получения хорошей структуры, пластичности и высокого предела прочности. Хорошо известны алюминиевые сплавы, содержащие всего 0,1% Литий, - аэрон и склерон; помимо лёгкости, они обладают высокой прочностью, пластичностью, стойкостью против коррозии и очень перспективны для авиастроения. Добавка 0,04% Литий к свинцово- href="http://Ca-Calcium.info/">кальциевым подшипниковым сплавам повышает их твёрдость и понижает трение. Соединения Литий используются для получения пластичных смазок. По значимости в современной технике Литий - один из важнейших редких элементов.
В. Е. Плющев.
Литий в организме. Литий постоянно входит в состав живых организмов, однако его биологическая роль выяснена недостаточно. Установлено, что у растений Литий повышает устойчивость к болезням, усиливает фотохимическую активность хлоропластов в листьях (томаты) и синтез никотина (табак). Способность концентрировать Литий сильнее всего выражена среди морских организмов у красных и бурых водорослей, а среди наземных растений - у представителей семейства Ranunculaceae (василистник, лютик) и семейства Solanaceae (дереза). У животных Литий концентрируется главным образом в печени и лёгких.
Лит.: Плющев В. Е., Степин Б. Д., Химия и технология соединений лития, рубидия и цезия, М., 1970; Ландольт П., Ситтиг М., Литий, в кн.: Справочник по редким металлам, пер. с англ., М., 1965.
| "БСЭ" >> "Л" >> "ЛИ" >> "ЛИТ" >> "ЛИТИ" |
Статья про "Литий" в Большой Советской Энциклопедии была прочитана 742 раз
| Коптим скумбрию в коробке |
| Семга на горелке |
TOP 20
- Лемке Михаил Константинович
- Сульфгидрильные группы
- «Казарменный коммунизм»
- Японское море
- Периодическая система элементов
- Объединённая партия гаитянских коммунистов
- Глициния
- Башкирская Автономная Советская Социалистическая Республика
- Иммунитет (историч.)
- Андаманское море
- Сенсуализм
- Балкано-кавказская раса
- «Сообразительный»
- Навигация (морск.)
- Звёздная астрономия
- Ямполь (пос. гор. типа в Донецкой обл.)
- Кульчицкая Елена Львовна
- Мандельштама - Бриллюэна рассеяние
- Театральные учебные заведения
- Электрическая постоянная