


БНБ
"БСЭ" (95279)
- Photogallery
- Естественные науки - Математика - Технология
- Авиация и машиностроение
- Высокие технологии
- Вычислительная техника
- Нанотехнология
- Роботехника
- Энергетика
- Электроника
Таллий
Определение "Таллий" в Большой Советской Энциклопедии
Таллий (лат. Thallium), Tl, химический элемент III группы периодической системы Менделеева, атомный номер 81, атомная масса 204,37; на свежем разрезе серый блестящий металл; относится к редким рассеянным элементам. В природе элемент представлен двумя стабильными изотопами 203Tl (29,5%) и 205Tl (70,5%) и радиоактивными изотопами 207Tl— 210Tl — членами радиоактивных рядов. Искусственно получены радиоактивные изотопы 202Tl (T1/2 = 12,5 сут), 204Tl (T1/2 = 4,26 года) и 206Tl (T1/2 = 4,19 мин). Таллий открыт в 1861 У. Круксом в шламе сернокислотного производства спектроскопическим методом по характерной зелёной линии в спектре (отсюда название: от греч. thallós — молодая, зелёная ветка). В 1862 французский химик К. О. Лами впервые выделил Таллий и установил его металлическую природу.
Распространение в природе. Среднее содержание Таллий в земной коре (кларк) 4,5×10-5% по массе, но благодаря крайнему рассеянию его роль в природных процессах невелика. В природе встречаются преимущественно соединения одновалентного и реже трёхвалентного Таллий Как и щелочные металлы, Таллий концентрируется в верхней части земной коры — в гранитном слое (среднее содержание 1,5×10–4%), в основных породах его меньше (2×10–5%), а в ультраосновных лишь 1×10–6%. Известно лишь семь минералов Таллий (например, круксит, лорандит, врбаит и др.), все они крайне редкие. Наибольшее геохимическое сходство Таллий имеет с К, Rb, Cs, а также с Pb, Ag, Cu, Bi (см. Рассеянные элементы, Рассеянных элементов руды). Таллий легко мигрирует в биосфере. Из природных вод он сорбируется углями, глинами, гидроокислами марганца, накапливается при испарении воды (например, в озере Сиваш до 5×10–8 г/л).
Физические и химические свойства. Таллий мягкий металл, на воздухе легко окисляется и быстро тускнеет. Таллий при давлении 0,1 Мн/м2 (1 кгс/см2) и температуре ниже 233 °С имеет гексагональную плотноупакованную решётку (а = 3,4496 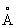 ; с = 5,5137
; с = 5,5137 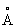 ), выше 233 °С — объёмноцентрированную кубическую (а = 4,841
), выше 233 °С — объёмноцентрированную кубическую (а = 4,841 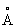 ), при высоких давлениях 3,9 Гн/м2 (39000 кгс/см2) — гранецентрированную кубическую; плотность 11,85г/см3; атомный радиус 1,71
), при высоких давлениях 3,9 Гн/м2 (39000 кгс/см2) — гранецентрированную кубическую; плотность 11,85г/см3; атомный радиус 1,71 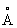 , ионные радиусы: Tl+ 1,49
, ионные радиусы: Tl+ 1,49 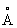 , Tl3+ 1,05
, Tl3+ 1,05 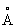 ; tпл 303,6 °С; tкип 1457 °С, удельная теплоёмкость 0,130 кджl (кг×K) [0,031 кал/г×С)} при 20—100 °С; температурный коэффициент линейного расширения 28×10–6 при 20 °С и 41,5×10–6 при 240—280 °С; теплопроводность 38,94 вт/(м×К) [0,093 кал/(см ×сек × °С)]. Удельное электросопротивление при 0°С (18×10–6ом ×см); температурный коэффициент электросопротивления 5,177×10–3 — 3,98 ×10–3 (0—100 °С). Температура перехода в сверхпроводящее состояние 2,39 К. Таллий диамагнитен, его удельная магнитная восприимчивость —0,249×10–6 (30 °С).
; tпл 303,6 °С; tкип 1457 °С, удельная теплоёмкость 0,130 кджl (кг×K) [0,031 кал/г×С)} при 20—100 °С; температурный коэффициент линейного расширения 28×10–6 при 20 °С и 41,5×10–6 при 240—280 °С; теплопроводность 38,94 вт/(м×К) [0,093 кал/(см ×сек × °С)]. Удельное электросопротивление при 0°С (18×10–6ом ×см); температурный коэффициент электросопротивления 5,177×10–3 — 3,98 ×10–3 (0—100 °С). Температура перехода в сверхпроводящее состояние 2,39 К. Таллий диамагнитен, его удельная магнитная восприимчивость —0,249×10–6 (30 °С).
Конфигурация внешней электронной оболочки атома Tl 6s26p1; в соединениях имеет степень окисления +1 [Tl (I)] и + 3 [Tl (III)]. Таллий взаимодействует с кислородом и галогенами уже при комнатной температуре, с серой и фосфором при нагревании. Хорошо растворяется в азотной, хуже в серной кислотах, не растворяется в галогенводородных, муравьиной, щавелевой и уксусной кислотах. Не взаимодействует с растворами щелочей; свежеперегнанная вода, не содержащая кислорода, не действует на Таллий Основные соединения с кислородом: закись Tl2O и окись Tl2O3.
Закись Таллий и соли Tl (I) нитрат, сульфат, карбонат — растворимы; хромат, бихромат, галогениды (за исключением фторида), а также окись Таллий — малорастворимы в воде. Tl (III) образует большое число комплексных соединений с неорганическими и органическими лигандами. Галогениды Tl (III) хорошо растворимы в воде. Наибольшее практическое значение имеют соединения Tl (I).
Получение. В промышленных масштабах технический Таллий получают попутно при переработке сульфидных руд цветных металлов и железа. Его извлекают из полупродуктов свинцового, цинкового и медного производств. Выбор способа переработки сырья зависит от его состава. Например, для извлечения Таллий и др. ценных компонентов из пылей свинцового производства проводится сульфатизация материала в кипящем слое при 300—350 °С. Полученную сульфатную массу выщелачивают водой, и из раствора экстрагируют Таллий 50%-ным раствором трибутилфосфата в керосине, содержащим йод, а затем реэкстрагируют серной кислотой (300 г/л) с добавкой 3%-ной перекиси водорода. Из реэкстрактов металл выделяют цементацией на цинковых листах. После переплавки под слоем едкого натра получают Таллий чистотой 99,99%. Для более глубокой очистки металла применяют электролитические рафинирование и кристаллизационную очистку.
Применение. В технике Таллий применяется, главным образом, в виде соединений. Монокристаллы твёрдых растворов галогенидов TIBr — TlI и TlCl — TlBr (известные в технике как КРС-5 и КРС-6) используют для изготовления оптических деталей в приборах инфракрасной техники; кристаллы TlCl и TlCl—TlBr — в качестве радиаторов счётчиков Черенкова. Tl2O входит в состав некоторых оптических стекол; сульфиды, оксисульфиды, селениды, теллуриды — компоненты полупроводниковых материалов, использующихся при изготовлении фотосопротивлений, полупроводниковых выпрямителей, видиконов. Водный раствор смеси муравьино- и малоновокислого Таллий (тяжёлая жидкость Клеричи) широко применяют для разделения минералов по плотности. Амальгама Таллий, затвердевающая при –59 °С, применяется в низкотемпературных термометрах. Металлический Таллий используют для получения подшипниковых и легкоплавких сплавов, а также в кислородомерах для определения кислорода в воде. 204Tl в качестве источника b-излучении применяют в радиоизотопных приборах.
Таллий И. Дарвойд.
Таллий в организме. Таллий постоянно присутствует в тканях растений и животных. В почвах его среднее содержание составляет 10–5%, в морской воде 10–9%, в организмах животных 4×10–5%. У млекопитающих Таллий хорошо всасывается из желудочно-кишечного тракта, накапливаясь главным образом в селезёнке и мышцах. У человека ежесуточное поступление Таллий с продуктами питания и водой составляет около 1,6 мкг, с воздухом — 0,05 мкг. Биологическая роль Таллий в организме не выяснена. Умеренно токсичен для растений и высоко токсичен для млекопитающих и человека.
Отравления Таллий и его соединениями возможны при их получении и практическом использовании. Таллий проникает в организм через органы дыхания, неповрежденную кожу и пищеварительный тракт. Выводится из организма в течение длительного времени, преимущественно с мочой и калом. Острые, подострые и хронические отравления имеют сходную клиническую картину, различаясь выраженностью и быстротой возникновения симптомов. В острых случаях через 1—2 сут появляются признаки поражения желудочно-кишечного тракта (тошнота, рвота, боли в животе, понос, запор) и дыхательных путей. Через 2—3 нед наблюдаются выпадение волос, явления авитаминоза (сглаживание слизистой оболочки языка, трещины в углах рта и т. д.). В тяжёлых случаях могут развиться полиневриты, психические расстройства, поражения зрения и др. Профилактика профессиональных отравлений: механизация производственных процессов, герметизация оборудования, вентиляция, использование средств индивидуальной защиты.
Л. П. Шабалика.
Лит.: Химия и технология редких и рассеянных элементов, под ред. К. А. Большакова, т. 1, [М., 1965]; 3еликман А. Н., Меерсон Г. А., Металлургия редких металлов, М., 1973; Таллий и его применение в современной технике, М., 1968; Тихова Г. С., Дарвойд Таллий И., Рекомендации по промышленной санитарии и технике безопасности при работе с таллием и его соединениями, в сборнике: Редкие металлы, в. 2, М., 1964; Воwen Н. Y. М., Trace elements in biochemistry, L.—N. Y., 1966.
Израэльсон З. И., Могилевская О. Я., Суворове. В. Вопросы гигиены труда и профессиональной патологии при работе с редкими металлами, М., 1973.
| "БСЭ" >> "Т" >> "ТА" >> "ТАЛ" >> "ТАЛЛ" |
Статья про "Таллий" в Большой Советской Энциклопедии была прочитана 512 раз
| Бургер двойного помола |
| Кишки на гриле |
TOP 20
- Лемке Михаил Константинович
- Сульфгидрильные группы
- «Казарменный коммунизм»
- Японское море
- Периодическая система элементов
- Глициния
- Башкирская Автономная Советская Социалистическая Республика
- Иммунитет (историч.)
- Андаманское море
- Сенсуализм
- «Сообразительный»
- Объединённая партия гаитянских коммунистов
- Балкано-кавказская раса
- Навигация (морск.)
- Звёздная астрономия
- Ямполь (пос. гор. типа в Донецкой обл.)
- Мандельштама - Бриллюэна рассеяние
- Кульчицкая Елена Львовна
- Театральные учебные заведения
- Электрическая постоянная