


БНБ
"БСЭ" (95279)
- Photogallery
- Естественные науки - Математика - Технология
- Авиация и машиностроение
- Высокие технологии
- Вычислительная техника
- Нанотехнология
- Роботехника
- Энергетика
- Электроника
Хром
Определение "Хром" в Большой Советской Энциклопедии
Хром (лат. Cromium), Cr, химический элемент VI группы периодической системы Менделеева, атомный номер 24, атомная масса 51,996; металл голубовато-стального цвета.
Природные стабильные изотопы: 50Cr (4,31%), 52Cr (87,76%), 53Cr (9,55%) и 54Cr (2,38%). Из шести искусственных радиоактивных изотопов наиболее важен 51Cr (период полураспада T1/2 = 27,8 сут), который применяется как изотопный индикатор.
Историческая справка. Хром открыт в 1797 Л. Н. Вокленом в минерале крокоите — природном хромате свинца PbCrO4. Название Хром получил от греческого слова chroma — цвет, краска (из-за разнообразия окраски своих соединений). Независимо от Воклена Хром был открыт в крокоите в 1798 немецким учёным М. Г. Клапротом.
Распространение в природе. Среднее содержание Хром в земной коре (кларк) 8,3×10-3%. Этот элемент, вероятно, более характерен для мантии Земли, т.к. ультраосновные породы, которые, как полагают, ближе всего по составу к мантии Земли, обогащены Хром (2×10-1%). Хром образует массивные и вкрапленные руды в ультраосновных горных породах; с ними связано образование крупнейших месторождений Хром (см. Хромовые руды). В основных породах содержание Хром достигает лишь 2×10-2%, в кислых — 2,5×10-3%, в осадочных породах (песчаниках) — 3,5×10-3%, глинистых сланцах — 9×10-3%. Хром — сравнительно слабый водный мигрант; содержание Хром в морской воде 0,00005 мг/л.
В целом Хром — металл глубинных зон Земли; каменные метеориты (аналоги мантии) тоже обогащены Хром (2,7×10-1%). Известно свыше 20 минералов Хром Промышленное значение имеют только хромшпинелиды (до 54% Cr); кроме того, Хром содержится в ряде др. минералов, которые нередко сопровождают хромовые руды, но сами не представляют практической ценности (уваровит, волконскоит, кемерит, фуксит).
А. И. Перельман.
Физические и химические свойства. Хром — твёрдый, тяжёлый, тугоплавкий металл. Чистый Хром пластичен. Кристаллизуется в объёмноцентрированной решётке, а = 2 885 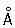 (20 °С); при ~ 1830 °С возможно превращение в модификацию с гранецентрированной решёткой, а = 3,69
(20 °С); при ~ 1830 °С возможно превращение в модификацию с гранецентрированной решёткой, а = 3,69 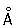 .
.
Атомный радиус 1,27 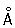 ; ионные радиусы Cr2+ 0,83
; ионные радиусы Cr2+ 0,83 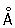 , Cr3+ 0,64
, Cr3+ 0,64 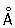 , Cr6+0,52
, Cr6+0,52 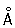 Плотность 7,19 г/см3; tпл 1890 °С; tкип 2480 °С. Удельная теплоёмкость 0,461 кдж/(кг×К.) [0,11 кал/(г×°С)] (25°С); термический коэффициент линейного расширения 8,24×10-6 (при 20 °С); коэффициент теплопроводности 67 вм/(м×К) [0,16 кал/(см×сек×°С)] (20 °С); удельное электросопротивление 0,414 мком×м (20°С); термический коэффициент электросопротивления в интервале 20—600 °С составляет 3,01×10-3. Хром антиферромагнитен, удельная магнитная восприимчивость 3,6×10-6. Твёрдость высокочистого Хром по Бринеллю 7—9 Мн/м2 (70—90 кгс/см2).
Плотность 7,19 г/см3; tпл 1890 °С; tкип 2480 °С. Удельная теплоёмкость 0,461 кдж/(кг×К.) [0,11 кал/(г×°С)] (25°С); термический коэффициент линейного расширения 8,24×10-6 (при 20 °С); коэффициент теплопроводности 67 вм/(м×К) [0,16 кал/(см×сек×°С)] (20 °С); удельное электросопротивление 0,414 мком×м (20°С); термический коэффициент электросопротивления в интервале 20—600 °С составляет 3,01×10-3. Хром антиферромагнитен, удельная магнитная восприимчивость 3,6×10-6. Твёрдость высокочистого Хром по Бринеллю 7—9 Мн/м2 (70—90 кгс/см2).
Внешняя электронная конфигурация атома Хром 3d5 4s1. В соединениях обычно проявляет степени окисления +2, +3, +6, среди них наиболее устойчивы Cr3+; известны отдельные соединения, в которых Хром имеет степени окисления +1, +4, +5. Хром химически малоактивен. При обычных условиях устойчив к кислороду и влаге, но соединяется с фтором, образуя CrF3. Выше 600 °С взаимодействует с парами воды, давая Cr2O3; азотом — Cr2N, CrN; углеродом — Cr23C6, Cr7C3, Cr3C2; серой — Cr2S3. При сплавлении с бором образует борид CrB, с кремнием — силициды Cr3Si, Cr2Si3, CrSi2. Со многими металлами Хром даёт сплавы (см. Хромовые сплавы). Взаимодействие с кислородом протекает сначала довольно активно, затем резко замедляется благодаря образованию на поверхности металла окисной плёнки. При 1200 °С плёнка разрушается и окисление снова идёт быстро. Хром загорается в кислороде при 2000 °С с образованием темно-зелёной окиси Хром Cr2O3. Помимо окиси, известны др. соединения с кислородом, например CrO, CrO3, получаемые косвенным путём (подробнее см. Хрома окислы). Хром легко реагирует с разбавленными растворами соляной и серной кислот с образованием хлорида и сульфата Хром и выделением водорода; царская водка и азотная кислота пассивируют Хром
С увеличением степени окисления возрастают кислотные и окислительные свойства Хром Производные Cr2+ — очень сильные восстановители. Ион Cr2+ образуется на первой стадии растворения Хром в кислотах или при восстановлении Cr3+ в кислом растворе цинком. Гидрат закиси Cr (OH)2 при обезвоживании переходит в CrO42-. Соединения Cr3+ устойчивы на воздухе. Могут быть и восстановителями и окислителями. Cr3+ можно восстановить в кислом растворе цинком до Cr2+ или окислить в щелочном растворе до CrO42- бромом и др. окислителями. Гидроокись Cr (OH)3 (вернее Cr2O3×nH2O — амфотерное соединение, образующее соли с катионом Cr3+ или соли хромистой кислоты HCrO2 — хромиты (например, KCrO2, NaCrO2). Соединения Cr6+: хромовый ангидрид CrO3, хромовые кислоты и их соли, среди которых наиболее важны хромоты и дихроматы (см. также Хромпик) — сильные окислители. Хром образует большое число солей с кислородсодержащими кислотами. Известны комплексные соединения Хром; особенно многочисленны комплексные соединения Cr3+, в которых Хром имеет координационное число 6. Существует значительное число перекисных соединений Хром
Получение. В зависимости от цели использования получают Хром различной степени чистоты. Сырьём обычно служат хромшпинелиды, которые подвергают обогащению, а затем сплавляют с поташом (или содой) в присутствии кислорода воздуха. Применительно к основному компоненту руд, содержащему Cr3+, реакция следующая:
2FeCr2O4 + 4К2СО3 + 3,5O2 = 4K2CrO4 + Fe2O3 + 4CO2.
Образующийся хромат калия K2CrO4 выщелачивают горячей водой и действием H2SO4 превращают его в дихромат K2Cr2O4. Далее действием концентрированного раствора H2SO4 на K2Cr2O7 получают хромовый ангидрид CrO3 или нагреванием K2Cr2O7 с серой — окись Хром Cr2O3.
Наиболее чистый Хром в промышленных условиях получают либо электролизом концентрированных водных растворов CrO3 или Cr2O3, содержащих H2SO4, либо электролизом сульфата Хром Cr2(SO4)3. При этом Хром выделяется на катоде из алюминия или нержавеющей стали. Полная очистка от примесей достигается обработкой Хром особо чистым водородом при высокой температуре (1500—1700 °С).
Возможно также получение чистого Хром электролизом расплавов CrF3 или CrCl3 в смеси с фторидами натрия, калия, кальция при температуре около 900 °С в атмосфере аргона.
В небольших количествах Хром получают восстановлением Cr2O3 алюминием или кремнием. При алюминотермическом способе предварительно подогретую шихту из Cr2O3 и порошка или стружек Al с добавками окислителя загружают в тигель, где реакцию возбуждают поджиганием смеси Na2O2 и Al до тех пор, пока тигель заполнится Хром и шлаком. Силикотермически Хром выплавляют в дуговых печах. Чистота получаемого Хром определяется содержанием примесей в Cr3O3 и в Al или Si, используемых для восстановления.
В промышленности в больших масштабах производятся сплавы Хром — феррохром и силикохром.
Применение. Использование Хром основано на его жаропрочности, твёрдости и устойчивости против коррозии. Больше всего Хром применяют для выплавки хромистых сталей (см. Хромаль, Хромель, Хромансиль). Алюмино- и силикотермический Хром используют для выплавки нихрома, нимоника, других никелевых сплавов и стеллита.
Значительное количество Хром идёт на декоративные коррозионно-стойкие покрытия (см. Хромирование). Широкое применение получил порошковый Хром в производстве металлокерамических изделий и материалов для сварочных электродов. Хром в виде иона Cr3+ — примесь в рубине, который используется как драгоценный камень и лазерный материал. Соединениями Хром протравливают ткани при крашении. Некоторые соли Хром используются как составная часть дубильных растворов в кожевенной промышленности; PbCrO4, ZnCrO4, SrCrO4 — как художественные краски. Из смеси хромита и магнезита изготовляют хромомагнезитовые огнеупорные изделия.
Соединения Хром (особенно производные C6+) токсичны.
А. Б. Сучков.
Хром в организме. Хром — один из биогенных элементов, постоянно входит в состав тканей растений и животных. Среднее содержание Хром в растениях — 0,0005% (92—95% Хром накапливается в корнях), у животных — от десятитысячных до десятимиллионных долей процента. В планктонных организмах коэффициент накопления Хром огромен — 10 000 — 26 000. Высшие растения не переносят концентрации Хром выше 3×10-4 моль/л. В листьях он присутствует в виде низкомолекулярного комплекса, не связанного с субклеточными структурами. Необходимость Хром для растений не доказана. У животных Хром участвует в обмене липидов, белков (входит в состав фермента трипсина), углеводов (структурный компонент глюкозоустойчивого фактора). Основной источник поступления Хром в организм животных и человека — пища. Снижение содержания Хром в пище и крови приводит к уменьшению скорости роста, увеличению холестерина в крови и снижению чувствительности периферийных тканей к инсулину.
М. Я. Школьник.
Отравлениях, и его соединениями встречаются при их производстве; в машиностроении (гальванические покрытия); металлургии (легирующие добавки, сплавы, огнеупоры); при изготовлении кож, красок и т.д. Токсичность соединений Хром зависит от их химической структуры: дихроматы токсичнее хроматов, соединения Cr (VI) токсичнее соединений Cr (II), Cr (lll). Начальные формы заболевания проявляются ощущением сухости и болью в носу, першением в горле, затруднением дыхания, кашлем и т.д.; они могут проходить при прекращении контакта с Хром При длительном контакте с соединениями Хром развиваются признаки хронического отравления: головная боль, слабость, диспепсия, потеря в весе и др. Нарушаются функции желудка, печени и поджелудочной железы. Возможны бронхит, бронхиальная астма, диффузный пневмосклероз. При воздействии Хром на кожу могут развиться дерматит, экзема. По некоторым данным, соединения Хром, преимущественно Cr (lll), обладают канцерогенным действием. Профилактика отравлений: периодические медицинские осмотры с участием отоларинголога; при гальванических процессах — местная вентиляция в виде бортовых отсосов у ванн, использование перчаток, защитных мазей; при наличии пыли, содержащей Хром, применяют респираторы, общие средства пылеподавления и пылеулавливания.
А. А. Каспаров.
Лит.: Салли А. Г., Брэндз Э. А., Хром, 2 изд., М., 1971; Некрасов Б. В., Основы общей химии, М., 1973; Ахметов Н. С., Неорганическая химия, 2 изд., М., 1975; Реми Г., Курс неорганической химии, пер. с нем., т. 1—2, М., 1972—74; Коттон Ф., Уилкинсон Дж., Современная неорганическая химия, пер. с англ., ч. 3, М., 1969; Грушко Я. М., Соединения хрома и профилактика отравлений ими, М., 1964; Bowen Н. J. М., Trace elements in biochemistry, L. — N. Y., 1966.
| "БСЭ" >> "Х" >> "ХР" >> "ХРО" |
Статья про "Хром" в Большой Советской Энциклопедии была прочитана 767 раз
| Бургер двойного помола |
| Креветки с газировкой |
TOP 20
- Лемке Михаил Константинович
- Сульфгидрильные группы
- «Казарменный коммунизм»
- Японское море
- Периодическая система элементов
- Глициния
- Башкирская Автономная Советская Социалистическая Республика
- Иммунитет (историч.)
- Андаманское море
- Объединённая партия гаитянских коммунистов
- Сенсуализм
- «Сообразительный»
- Балкано-кавказская раса
- Навигация (морск.)
- Звёздная астрономия
- Ямполь (пос. гор. типа в Донецкой обл.)
- Мандельштама - Бриллюэна рассеяние
- Кульчицкая Елена Львовна
- Театральные учебные заведения
- Электрическая постоянная