


БНБ
"БСЭ" (95279)
- Photogallery
- Естественные науки - Математика - Технология
- Авиация и машиностроение
- Высокие технологии
- Вычислительная техника
- Нанотехнология
- Роботехника
- Энергетика
- Электроника
Бор (химич. элемент)
Определение "Бор (химич. элемент)" в Большой Советской Энциклопедии
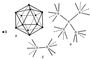 |
| Бор (химический элемент). Рис. |
Физические и химические свойства. Известно несколько кристаллических модификаций Бор (химич. элемент) Для двух из них рентгеноструктурным анализом удалось полностью определить кристаллическую структуру, которая в обоих случаях оказалась весьма сложной. Атомы Бор (химич. элемент) образуют в этих структурах трёхмерный каркас подобно атомам углерода в алмазе. Этим объясняется высокая твёрдость Бор (химич. элемент) Однако строение каркаса в структурах Бор (химич. элемент) гораздо сложнее, чем в алмазе. Основной структурной единицей в кристаллах Бор (химич. элемент) служат двадцатигранники (икосаэдры), в вершинах каждого из которых находятся 12 атомов Бор (химич. элемент) (рис., а). Икосаэдры соединяются между собой как непосредственно (рис., б), так и посредством промежуточных атомов Бор (химич. элемент), не входящих в состав какого-либо икосаэдра (рис., в). При таком строении оказывается, что атомы Бор (химич. элемент) в кристаллах имеют разные координационные числа: 4, 5, 6 и 5 + 2 (5 ближних «соседей» и 2 более далёких). Т. к. на внешней оболочке атома Бор (химич. элемент) находятся всего 3 электрона (электронная конфигурация 2s22p), на каждую присутствующую в кристаллическом Бор (химич. элемент) связь приходится существенно меньше двух электронов. В соответствии с современными представлениями, в кристаллах Бор (химич. элемент) осуществляется особый тип ковалентной связи — многоцентровая связь с дефицитом электронов. В соединениях ионного типа Бор (химич. элемент) 3-валентен. Так называемый «аморфный» Бор (химич. элемент), получаемый при восстановлении B2O3 металлическим натрием или калием, имеет плотность 1,73 г/см3. Чистый кристаллический Бор (химич. элемент) имеет плотность 2,3 г/см3, температуру плавления 2075 °С, температуру кипения 3860 °С; твёрдость Бор (химич. элемент) по минералогической шкале 9, микротвёрдость 34 Гн/м2 (3400 кгс/мм2). Кристаллический Бор (химич. элемент) — полупроводник. В обычных условиях он проводит электрический ток плохо. При нагревании до 800°С электрическая проводимость Бор (химич. элемент) увеличивается на несколько порядков, причём знак проводимости меняется (электронная — при низких температурах, дырочная — при высоких) (см. Полупроводниковые материалы).
Химически Бор (химич. элемент) при обычных условиях довольно инертен (взаимодействует активно лишь с фтором), причём кристаллический Бор (химич. элемент) менее активен, чем аморфный. С повышением температуры активность Бор (химич. элемент) возрастает и он соединяется с кислородом, серой, галогенами. При нагревании на воздухе до 700 °С Бор (химич. элемент) горит красноватым пламенем, образуя борный ангидрид B2O3 — бесцветную стекловидную массу. При нагревании выше 900 °С Бор (химич. элемент) с азотом образует бора нитрид BN, при нагревании с углём — бора карбид B4C, с металлами — бориды. С водородом Бор (химич. элемент) заметно не реагирует; его гидриды (бороводороды) получают косвенным путём. При температуре красного каления Бор (химич. элемент) взаимодействует с водяным паром: 2B + 3Н2О = B2O3 + 3H2. В кислотах Бор (химич. элемент) при обычной температуре не растворяется, кроме концентрированной азотной кислоты, которая окисляет его до борной кислоты H3BO3. Медленно растворяется в концентрированных растворах щелочей с образованием боратов.
Во фториде BF3 и других галогенидах Бор (химич. элемент) связан с галогенами тремя ковалентными связями. Поскольку для завершения устойчивой 8-электронной оболочки атому Бор (химич. элемент) в галогениде BX3 недостаёт пары электронов, молекулы галогенидов, особенно BFз, присоединяют молекулы других веществ, имеющие свободные электронные пары, например аммиака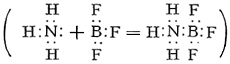
В таких комплексных соединениях атом Бор (химич. элемент) окружен четырьмя атомами (или группами атомов), что соответствует характерному для Бор (химич. элемент) в его соединениях координационному числу 4. Важные комплексные соединения Бор (химич. элемент) — борогидриды, например Na [BH4], и фтороборная, или борофтористоводородная, кислота H [BF4], образующаяся из BF3 и HF; большинство солей этой кислоты (фтороборатов) растворимы в воде (за исключением солей К, Rb, Cs). Общая особенность самого Бор (химич. элемент) и его соединений — их сходство с кремнием и его соединениями. Так, борная кислота, подобно кремниевой, обладает слабыми кислотными свойствами и растворяется в HF с образованием газообразного BF3 (кремниевая даёт SiF4). Бороводороды напоминают кремневодороды, а карбид Бор (химич. элемент) — карбид кремния, и т.д. Представляет интерес особое сходство модификаций нитрида BN с графитом или алмазом. Это связано с тем, что атомы В и N по электронной конфигурации совместно имитируют 2 атома С (у В — 3 валентных электрона, у N — 5, у двух атомов С — по 4). Эта аналогия характерна и для других соединений, содержащих одновременно Бор (химич. элемент) и азот. Так, боразан BH3—NH3 подобен этану СН3—СН3, а боразен BH2=NH2 и простейший боразин BHºNH подобны соответственно этилену СН2=СН2 и ацетилену CHºCH. Если тримеризация ацетилена C2H2 даёт бензол C6H6, то аналогичный процесс приводит от боразина BHNH к боразолу B3N3H6 (см. также Борорганические соединения).
Получение и применение. Элементарный Бор (химич. элемент) из природного сырья получают в несколько стадий. Разложением боратов горячей водой или серной кислотой (в зависимости от их растворимости) получают борную кислоту, а её обезвоживанием — борный ангидрид. Восстановление В2О3 металлическим магнием даёт Бор (химич. элемент) в виде темно-бурого порошка; от примесей его очищают обработкой азотной и плавиковой кислотами. Очень чистый Бор (химич. элемент), необходимый в производстве полупроводников, получают из его галогенидов: восстанавливают BCl3 водородом при 1200°С или разлагают пары BBr3 на танталовой проволоке, раскалённой до 1500°С. Чистый Бор (химич. элемент) получают также термическим разложением бороводородов.
Бор (химич. элемент) в небольших количествах (доли %) вводят в сталь и некоторые сплавы для улучшения их механических свойств; уже присадка к стали 0,001—0,003% Бор (химич. элемент) повышает её прочность (обычно в сталь вводят Бор (химич. элемент) в виде ферробора, т. е. сплава железа с 10—20% Бор (химич. элемент)). Поверхностное насыщение стальных деталей бором (до глубины 0,1—0,5 мм) улучшает не только механические свойства, но и стойкость стали против коррозии (см. Борирование). Благодаря способности изотопа 10В поглощать тепловые нейтроны, его применяют для изготовления регулирующих стержней ядерных реакторов, служащих для прекращения или замедления реакции деления. Бор (химич. элемент) в виде газообразного BF3 используют в счётчиках нейтронов. (При взаимодействии ядер 10В с нейтронами образуются заряженные a-частицы, которые легко регистрировать; число же a-частиц равно числу нейтронов, поступивших в счётчик: 105B + 10n = 73Li + 42a) (см. также Нейтронные детекторы и индикаторы). Сам Бор (химич. элемент) и его соединения — нитрид BN, карбид B4C, фосфид ВР и др. — применяют как диэлектрики и полупроводниковые материалы. Обширное применение находят борная кислота и её соли (прежде всего бура), бориды и др. BF3 — катализатор некоторых органических реакций.
Лит.: Некрасов Бор (химич. элемент) В., Основы общей химии, т. 2, М., 1967; Щукарев С. А., Лекции по курсу общей химии, т. 2, Л., 1964; Бор, его соединения и сплавы, К., 1960.
В. Л. Василевский.
Бор (химич. элемент) в организме. Бор (химич. элемент) относится к числу химических элементов, которые в очень малых количествах содержатся в тканях растений и животных (тысячные и десятитысячные доли % на сухую массу). Бор (химич. элемент) необходим для поддержания нормальной жизнедеятельности растений. Важнейший симптом недостатка Бор (химич. элемент) — отмирание точки роста главного стебля, а затем и пазушных почек. Одновременно черешки и листья становятся хрупкими, цветки не появляются или не образуются плоды; поэтому при недостатке Бор (химич. элемент) падает урожай семян. Известны многие болезни, связанные с недостатком Бор (химич. элемент), например гниль сердечка сахарной свёклы, чёрная пятнистость столовой свёклы, побурение сердцевины брюквы и цветной капусты, засыхание верхушки льна, желтуха верхушки люцерны, бурая пятнистость абрикосов, опробковение яблок. При недостатке Бор (химич. элемент) замедляется окисление сахаров, аминирование продуктов углеводного обмена, синтез клеточных белков; однако ферменты, для которых Бор (химич. элемент) является необходимым элементом, пока неизвестны. По данным М. Я. Школьника, при недостатке Бор (химич. элемент) у растений снижается содержание аденозинтрифосфорной кислоты, а также нарушается процесс окислительного фосфорилирования, вследствие чего энергия, выделяющаяся при дыхании, не может быть использована для синтеза необходимых веществ. При недостатке Бор (химич. элемент) в почве в неё вносят борные удобрения (см. Микроудобрения). В биогеохимических провинциях с избытком Бор (химич. элемент) в почве (например, в Северо-Западном Казахстане) возникают морфологические изменения и заболевания растений, вызываемые накоплением Бор (химич. элемент), — гигантизм, карликовость, нарушение точек роста и др. На почвах с интенсивным борным засолением встречаются участки, лишённые растительности, «плешины», — один из поисковых признаков месторождения Бор (химич. элемент) Значение Бор (химич. элемент) в организме животных пока не выяснено. У человека и животных (овец, верблюдов) при питании растениями с избыточным содержанием Бор (химич. элемент) (60—600 мг/кг сухого вещества и более) нарушается обмен веществ (в частности, активность протеолитических ферментов) и появляется эндемическое заболевание желудочно-кишечного тракта — борный энтерит.
Лит.: Скок Дж., функция бора в растительной клетке, в кн.: Микроэлементы, пер. с англ., М., 1962; Ковальский В. В., Ананичев А. В., Шахова И. К., Борная биогеохимическая провинция Северо-Западного Казахстана, «Агрохимия», 1965, № 11.
В. В. Ковальский.
| "БСЭ" >> "Б" >> "БО" >> "БОР" >> "БОРХ" |
Статья про "Бор (химич. элемент)" в Большой Советской Энциклопедии была прочитана 666 раз
| Коптим скумбрию в коробке |
| Бургер двойного помола |
TOP 20
- Лемке Михаил Константинович
- Сульфгидрильные группы
- «Казарменный коммунизм»
- Японское море
- Периодическая система элементов
- Глициния
- Башкирская Автономная Советская Социалистическая Республика
- Иммунитет (историч.)
- Объединённая партия гаитянских коммунистов
- Андаманское море
- Сенсуализм
- «Сообразительный»
- Балкано-кавказская раса
- Навигация (морск.)
- Звёздная астрономия
- Ямполь (пос. гор. типа в Донецкой обл.)
- Мандельштама - Бриллюэна рассеяние
- Кульчицкая Елена Львовна
- Театральные учебные заведения
- Электрическая постоянная