


БНБ
"БСЭ" (95279)
- Photogallery
- Естественные науки - Математика - Технология
- Авиация и машиностроение
- Высокие технологии
- Вычислительная техника
- Нанотехнология
- Роботехника
- Энергетика
- Электроника
Алюминий
Определение "Алюминий" в Большой Советской Энциклопедии
Алюминий (лат. Aluminium), Al, химический элемент III группы периодической системы Менделеева; атомный номер 13, атомная масса 26,9815; серебристо-белый лёгкий металл. Состоит из одного стабильного изотопа 27Al.
Историческая справка. Название Алюминий происходит от латинского alumen — так ещё за 500 лет до н. э. назывались алюминиевые квасцы, которые применялись как протрава при крашении тканей и для дубления кожи. Датский учёный Х. К. Эрстед в 1825, действуя амальгамой калия на безводный AlCl3 и затем отгоняя ртуть, получил относительно чистый Алюминий Первый промышленный способ производства Алюминий предложил в 1854 французский химик Алюминий Э. Сент-Клер Девиль: способ заключался в восстановлении двойного хлорида Алюминий и натрия Na3AICI6 металлическим натрием. Похожий по цвету на серебро, Алюминий на первых порах ценился очень дорого. С 1855 по 1890 было получено всего 200 т Алюминий Современный способ получения Алюминий электролизом криолито-глинозёмного расплава разработан в 1886 одновременно и независимо друг от друга Ч. Холлом в США и П. Эру во Франции.
Распространённость в природе. По распространённости в природе Алюминий занимает 3-е место после кислорода и кремния и 1-е — среди металлов. Его содержание в земной коре составляет по массе 8,80%. В свободном виде Алюминий в силу своей химической активности не встречается. Известно несколько сотен минералов Алюминий, преимущественно алюмосиликатов. Промышленное значение имеют боксит, алунит и нефелин. Нефелиновые породы беднее бокситов глинозёмом, но при их комплексном использовании получаются важные побочные продукты: сода, поташ, серная кислота. В СССР разработан метод комплексного использования нефелинов. Нефелиновые руды в СССР образуют, в отличие от бокситов, весьма крупные месторождения и создают практически неограниченные возможности для развития алюминиевой промышленности.
Физические и химические свойства. Алюминий сочетает весьма ценный комплекс свойств: малую плотность, высокие теплопроводность и электрическую проводимость, высокую пластичность и хорошую коррозионную стойкость. Он легко поддаётся ковке, штамповке, прокатке, волочению. Алюминий хорошо сваривается газовой, контактной и др. видами сварки. Решётка Алюминий кубическая гранецентрированная с параметром а = 4,0413 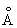 . Свойства Алюминий, как и всех металлов, в значительной степени зависят от его чистоты. Свойства Алюминий особой чистоты (99,996% ): плотность (при 20°С) 2698,9 кг/м3, tпл 660,24°С; tkип около 2500°С: коэффициент термического расширения (от 20° до 100°С) 23,86•10-6; теплопроводность (при 190°С) 343 вт/м•К (0,82 кал/см•сек•°С), удельная теплоёмкость (при 100°С) 931,98 дж/кг К (0,2226•кал/г•°С); электропроводность по отношению к меди (при 20°С) 65,5%. Алюминий обладает невысокой прочностью (предел прочности 50—60 Мн/м2), твёрдостью (170 Мн/м2 по Бринеллю) и высокой пластичностью (до 50% ). При холодной прокатке предел прочности Алюминий возрастает до 115 Мн/м2, твёрдость — до 270 Мн/м2, относительное удлинение снижается до 5% (1 Мн/м2 » 0,1 кгс/мм2). Алюминий хорошо полируется, анодируется и обладает высокой отражательной способностью, близкой к серебру (он отражает до 90% падающей световой энергии). Обладая большим сродством к кислороду, Алюминий на воздухе покрывается тонкой, но очень прочной плёнкой окиси Al2O3, защищающей металл от дальнейшего окисления и обусловливающей его высокие антикоррозионные свойства. Прочность окисной плёнки и защитное действие её сильно убывают в присутствии примесей ртути, натрия, магния, меди и др. Алюминий стоек к действию атмосферной коррозии, морской и пресной воды, практически не взаимодействует с концентрированной или сильно разбавленной азотной кислотой,с органическими кислотами, пищевыми продуктами.
. Свойства Алюминий, как и всех металлов, в значительной степени зависят от его чистоты. Свойства Алюминий особой чистоты (99,996% ): плотность (при 20°С) 2698,9 кг/м3, tпл 660,24°С; tkип около 2500°С: коэффициент термического расширения (от 20° до 100°С) 23,86•10-6; теплопроводность (при 190°С) 343 вт/м•К (0,82 кал/см•сек•°С), удельная теплоёмкость (при 100°С) 931,98 дж/кг К (0,2226•кал/г•°С); электропроводность по отношению к меди (при 20°С) 65,5%. Алюминий обладает невысокой прочностью (предел прочности 50—60 Мн/м2), твёрдостью (170 Мн/м2 по Бринеллю) и высокой пластичностью (до 50% ). При холодной прокатке предел прочности Алюминий возрастает до 115 Мн/м2, твёрдость — до 270 Мн/м2, относительное удлинение снижается до 5% (1 Мн/м2 » 0,1 кгс/мм2). Алюминий хорошо полируется, анодируется и обладает высокой отражательной способностью, близкой к серебру (он отражает до 90% падающей световой энергии). Обладая большим сродством к кислороду, Алюминий на воздухе покрывается тонкой, но очень прочной плёнкой окиси Al2O3, защищающей металл от дальнейшего окисления и обусловливающей его высокие антикоррозионные свойства. Прочность окисной плёнки и защитное действие её сильно убывают в присутствии примесей ртути, натрия, магния, меди и др. Алюминий стоек к действию атмосферной коррозии, морской и пресной воды, практически не взаимодействует с концентрированной или сильно разбавленной азотной кислотой,с органическими кислотами, пищевыми продуктами.
Внешняя электронная оболочка атома Алюминий состоит из 3 электронов и имеет строение 3s23р. В обычных условиях Алюминий в соединениях 3-валентен, но при высоких температурах может быть одновалентным, образуя т. н. субсоединения. Субгалогениды Алюминий, AIF и AlCl, устойчивые лишь в газообразном состоянии, в вакууме или в инертной атмосфере, при понижении температуры распадаются (диспропорционируют) на чистый Al и AlF3 или AlCl3 и поэтому могут быть использованы для получения сверхчистого Алюминий При накаливании мелкоизмельчённый или порошкообразный Алюминий энергично сгорает на воздухе. Сжиганием Алюминий в токе кислорода достигается температура выше 3000°С. Свойством Алюминий активно взаимодействовать с кислородом пользуются для восстановления металлов из их окислов (см. Алюминотермия). При тёмно-красном калении фтор энергично взаимодействует с Алюминий, образуя AIF3 (см. Алюминия фторид). Хлор и жидкий бром реагируют с Алюминий при комнатной температуре, иод — при нагревании (см. Алюминия хлорид). При высокой температуре Алюминий соединяется с азотом, углеродом и серой, образуя соответственно нитрид AIN, карбид Al4C3 и сульфид Al2S3. С водородом Алюминий не взаимодействует; гидрид Алюминий (AlH3)x получен косвенным путём. Большой интерес представляют двойные гидриды Алюминий и элементов l и II групп периодической системы состава MeHn-nAlH3, т.н. алюмогидриды (см. Алюминия гидрид). Алюминий легко растворяется в щелочах, выделяя водород и образуя алюминаты. Большинство солей Алюминий хорошо растворимо в воде. Растворы солей Алюминий вследствие гидролиза показывают кислую реакцию (см. Алюминия сульфат, Алюминия нитрат).
Получение. В промышленности Алюминий получают электролизом глинозёма Al2O3 (см. Алюминия окись), растворённого в расплавленном криолите Na3AlF6 при температуре около 950°С. Используются электролизеры трёх основных конструкций: 1) электролизеры с непрерывными самообжигающимися анодами и боковым подводом тока, 2) то же, но с верхним подводом тока и 3) электролизеры с обожжёнными анодами. Электролитная ванна представляет собой железный кожух, футерованный внутри тепло- и электроизолирующим материалом — огнеупорным кирпичом, и выложенный угольными плитами и блоками. Рабочий объём заполняется расплавленным электролитом, состоящим из 6—8% глинозёма и 94—92% криолита (обычно с добавкой AlF6 и около 5—6% смеси фторидов калия и магния). Катодом служит подина ванны, анодом — погруженные в электролит угольные обожжённые блоки или же набивные самообжигающиеся электроды. При прохождении тока на катоде выделяется расплавленный Алюминий, который накапливается на подине, а на аноде — кислород, образующий с угольным анодом CO и CO2. К глинозёму, основному расходуемому материалу, предъявляются высокие требования по чистоте и размерам частиц. Присутствие в нём окислов более электроположительных элементов, чем Алюминий, ведёт к загрязнению Алюминий При достаточном содержании глинозёма ванна работает нормально при электрическом напряжении порядка 4—4,5 в. Ванны присоединяют к источнику постоянного тока последовательно (сериями из 150—160 ванн). Современные электролизеры работают при силе тока до 150 ка. Из ванн Алюминий извлекают обычно с помощью вакуум-ковша. Расплавленный Алюминий чистотой 99,7% разливают в формы. Алюминий высокой чистоты (99,9965%) получают электролитическим рафинированием первичного Алюминий с помощью т. н. трёхслойного способа, снижающего содержание примесей Fe, Si и Cu. Исследования процесса электролитического рафинирования Алюминий с применением органических электролитов показали принципиальную возможность получения Алюминий чистотой 99,999% при относительно низком расходе энергии, но пока этот метод обладает низкой производительностью. Для глубокой очистки Алюминий применяют зонную плавку или дистилляцию его через субфторид.
При электролитическом производстве Алюминий возможны поражения электрическим током, высокой температурой и вредными газами. Для избежания несчастных случаев ванны надёжно изолируют, рабочие пользуются сухими валенками, соответствующей спецодеждой. Здоровая атмосфера поддерживается эффективной вентиляцией. При постоянном вдыхании пыли металлического Алюминий и его окиси может возникнуть алюминоз лёгких (см. Пневмокониозы). У рабочих, занятых в производстве Алюминий, часты катары верхних дыхательных путей (риниты, фарингиты, ларингиты). Предельно допустимая концентрация в воздухе пыли металлического Алюминий, его окиси и сплавов 2 мг/м3.
Применение. Сочетание физических, механических и химических свойств Алюминий определяет его широкое применение практически во всех областях техники, особенно в виде его сплавов с др. металлами (см. Алюминиевые сплавы). В электротехнике Алюминий успешно заменяет медь, особенно в производстве массивных проводников, например в воздушных линиях, высоковольтных кабелях, шинах распределительных устройств, трансформаторах (электрическая проводимость Алюминий достигает 65,5% электрической проводимости меди, и он более чем в три раза легче меди; при поперечном сечении, обеспечивающем одну и ту же проводимость, масса проводов из Алюминий вдвое меньше медных). Сверхчистый Алюминий употребляют в производстве электрических конденсаторов и выпрямителей, действие которых основано на способности окисной плёнки Алюминий пропускать электрический ток только в одном направлении. Сверхчистый Алюминий, очищенный зонной плавкой, применяется для синтеза полупроводниковых соединений типа AIIIBV, применяемых для производства полупроводниковых приборов. Чистый Алюминий используют в производстве разного рода зеркал отражателей. Алюминий высокой чистоты применяют для предохранения металлических поверхностей от действия атмосферной коррозии (плакирование, алюминиевая краска). Обладая относительно низким сечением поглощения нейтронов, Алюминий применяется как конструкционный материал в ядерных реакторах.
В алюминиевых резервуарах большой ёмкости хранят и транспортируют жидкие газы (метан, кислород, водород и т. д.), азотную и уксусную кислоты, чистую воду, перекись водорода и пищевые масла. Алюминий широко применяют в оборудовании и аппаратах пищевой промышленности, для упаковки пищевых продуктов (в виде фольги), для производства разного рода бытовых изделий. Резко возросло потребление Алюминий для отделки зданий, архитектурных, транспортных и спортивных сооружений.
В металлургии Алюминий. (помимо сплавов на его основе) — одна из самых распространённых легирующих добавок в сплавах на основе Cu, Mg, Ti, Ni, Zn и Fe. Применяют Алюминий также для раскисления стали перед заливкой её в форму, а также в процессах получения некоторых металлов методом алюминотермии. На основе Алюминий методом порошковой металлургии создан САП (спечённый алюминиевый порошок), обладающий при температурах выше 300°С большой жаропрочностью.
Алюминий используют в производстве взрывчатых веществ (аммонал, алюмотол). Широко применяют различные соединения Алюминий
Производство и потребление Алюминий непрерывно растет, значительно опережая по темпам роста производство стали, меди, свинца, цинка.
Лит.: Беляев Алюминий И., Вольфсон Г. Е., Лазарев Г. И..Фирсанова Л. Алюминий, Получение чистого алюминия, [М.], 1967; Беляев Алюминий И., Рапнопорт Н.. Б., Фирсанова Л. Алюминий, Электрометаллургия алюминия, М., 1953; Беляев Алюминий И., История алюминия, в сборнике: Труды института истории естествознания и техники, т. 20, М., 1959; Фридляндер И. Н., Алюминий и его сплавы, М., 1965.
Ю. И. Романьков.
Геохимия Алюминий Геохимические черты Алюминий определяются его большим сродством к кислороду (в минералах Алюминий входит в кислородные октаэдры и тетраэдры), постоянной валентностью (3), слабой растворимостью большинства природных соединений. В эндогенных процессах при застывании магмы и формировании изверженных пород Алюминий входит в кристаллическую решётку полевых шпатов, слюд и др. минералов — алюмосиликатов. В биосфере Алюминий — слабый миграт, его мало в организмах и гидросфере. Во влажном климате, где разлагающиеся остатки обильной растительности образуют много органических кислот, Алюминий мигрирует в почвах и водах в виде органо-минеральных коллоидных соединений; Алюминий адсорбируется коллоидами и осаждается в нижней части почв. Связь Алюминий с кремнием частично нарушается и местами в тропиках образуются минералы — гидроокислы Алюминий — бёмит, диаспор, гидраргиллит. Большая же часть Алюминий входит в состав алюмосиликатов — каолинита, бейделлита и др. глинистых минералов. Слабая подвижность определяет остаточное накопление Алюминий в коре выветривания влажных тропиков. В результате образуются элювиальные бокситы. В прошлые геологические эпохи бокситы накапливались также в озёрах и прибрежной зоне морей тропических областей (например, осадочные бокситы Казахстана). В степях и пустынях, где живого вещества мало, а воды нейтральные и щелочные, Алюминий почти не мигрирует. Наиболее энергична миграция Алюминий в вулканических областях, где наблюдаются сильнокислые речные и подземные воды, богатые Алюминий В местах смешения кислых вод с щелочными — морскими (в устьях рек и др.), Алюминий осаждается с образованием бокситовых месторождений.
Алюминий И. Перельман.
Алюминий в организме. Алюминий входит в состав тканей животных и растений; в органах млекопитающих животных обнаружено от 10-3 до 10-5% Алюминий (на сырое вещество). Алюминий накапливается в печени, поджелудочной и щитовидной железах. В растительных продуктах содержание Алюминий колеблется от 4 мг на 1 кг сухого вещества (картофель) до 46 мг (жёлтая репа), в продуктах животного происхождения — от 4 мг (мёд) до 72 мг на 1кг сухого вещества (говядина). В суточном рационе человека содержание Алюминий достигает 35—40 мг. Известны организмы — концентраторы Алюминий, например плауны (Lycopodiaceae), содержащие в золе до 5,3% Алюминий, моллюски (Helix и Lithorina), в золе которых 0,2—0,8% Алюминий Образуя нерастворимые соединения с фосфатами, Алюминий нарушает питание растений (поглощение фосфатов корнями) и животных (всасывание фосфатов в кишечнике).
Лит.: Войнар Алюминий О., Биологическая роль микроэлементов в организме животных и человека, 2 изд., М., 1960, с. 73—77.
В.В. Ковальский.
| "БСЭ" >> "А" >> "АЛ" >> "АЛЮ" |
Статья про "Алюминий" в Большой Советской Энциклопедии была прочитана 858 раз
| Пицца в сковороде |
| Морской Гребешок в беконе |
TOP 20
- Лемке Михаил Константинович
- Сульфгидрильные группы
- «Казарменный коммунизм»
- Японское море
- Периодическая система элементов
- Глициния
- Башкирская Автономная Советская Социалистическая Республика
- Иммунитет (историч.)
- Андаманское море
- Сенсуализм
- Объединённая партия гаитянских коммунистов
- «Сообразительный»
- Балкано-кавказская раса
- Навигация (морск.)
- Звёздная астрономия
- Ямполь (пос. гор. типа в Донецкой обл.)
- Мандельштама - Бриллюэна рассеяние
- Кульчицкая Елена Львовна
- Театральные учебные заведения
- Электрическая постоянная