


БНБ
"БСЭ" (95279)
- Photogallery
- Естественные науки - Математика - Технология
- Авиация и машиностроение
- Высокие технологии
- Вычислительная техника
- Нанотехнология
- Роботехника
- Энергетика
- Электроника
Изоморфизм (химич.)
Определение "Изоморфизм (химич.)" в Большой Советской Энциклопедии
Изоморфизм (от изо... и греч. morphé - вид, форма), свойство веществ, аналогичных по химическому составу, кристаллизоваться в одинаковых формах. Впервые было показано немецким минералогом Э. Мичерлихом (1819) на примере KH2PO4, KH2AsO4 и NH4H2PO4. Вскоре было обнаружено, что первые два вещества образуют смешанные кристаллы («твёрдые растворы») с единой внешней формой при произвольном отношении P : As, в то время как в других парах аналогичные замещения ограничены количественно. Первый случай отвечает понятию «совершенный Изоморфизм (химич.)», а второй - понятию «ограниченный», или «несовершенный Изоморфизм (химич.)». Если количества замещающего элемента невелики, но существенны для поисковика минералога-геохимика, то говорят об эндокриптии (по А. Е. Ферсману, замещение узлов кристаллических решёток ионами того же знака, но разных свойств и мало сходных величин). Требование родственности взаимозамещающихся элементов при Изоморфизм (химич.) первоначально понималось как чисто химическая близость, и первые ряды изоморфных элементов (В. Изоморфизм (химич.) Вернадский; см. Геохимия) повторяли группы менделеевской системы с некоторыми дополнениями известных из аналитической химии групп, например Al, Cr, Fe. Выяснилось, однако, что невозможно, например, замещение Na на Rb; твёрдые растворы К- и Na-coeдинений энергично распадаются при низких температурах (распад К-, Na-полевых шпатов). Решающим для объяснения этих явлений при Изоморфизм (химич.) было введение (В. М. Гольдшмидт, 1926) представления об ионных радиусах, близость которых стала одним из основных условий Изоморфизм (химич.) У полновалентных катионов (Na1+, Mg2+,..., S6+,...) ионный радиус r быстро уменьшается вдоль строки менделеевской системы и резко увеличивается вдоль вертикали на величины, большие чем 10-15% (экспериментальный предел для возможности Изоморфизм (химич.)). В результате изоморфными оказываются элементы, соседние по диагоналям (Д. Изоморфизм (химич.) Менделеев, А. Е. Ферсман), например ряд Na-Ca (rNa = 0,98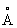 , rCa = 1,02
, rCa = 1,02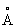 ), который представлен в плагиоклазах, составляющих более 50% земной коры. Эта диагональ продолжается к редкоземельным элементам, и именно благодаря постоянному изоморфному вхождению редкоземельных элементов в Са-минералы эти элементы долгое время считались двухвалентными (только Д. Изоморфизм (химич.) Менделеев перевёл их в III группу). Другие характерные «диагональные» пары: Li-Mg, Mo-Re, Be-Al и т. д. Если, однако, строки менделеевской системы длинные (с 32 клетками), то описанное сокращение радиусов вдоль строки заходит так далеко, что катионы одной и той же менделеевской группы выравнивают свои радиусы, т. е. у элементов одной группы, разделённых по вертикали «лантанидным сжатием», Изоморфизм (химич.) становится весьма ярко выраженным. Это относится к парам Ba-Ra, Zr-Hf, Nb-Ta и др. Но как ни близки между собой Nb и Ta, их легче отделить друг от друга, чем отделить от Ti, с которым они связаны диагональным изоморфизмом. Таким образом, изовалентный Изоморфизм (химич.) представлен намного скромнее (во всяком случае количественно), чем гетеровалентный Изоморфизм (химич.) Возникает вопрос, как компенсировать в структуре кристалла изменение валентности, например её увеличение при Изоморфизм (химич.) Ca2+ ® Na1+. Решение просто, когда элемент на середине диагонали замещается двумя соседними по разные стороны, например
), который представлен в плагиоклазах, составляющих более 50% земной коры. Эта диагональ продолжается к редкоземельным элементам, и именно благодаря постоянному изоморфному вхождению редкоземельных элементов в Са-минералы эти элементы долгое время считались двухвалентными (только Д. Изоморфизм (химич.) Менделеев перевёл их в III группу). Другие характерные «диагональные» пары: Li-Mg, Mo-Re, Be-Al и т. д. Если, однако, строки менделеевской системы длинные (с 32 клетками), то описанное сокращение радиусов вдоль строки заходит так далеко, что катионы одной и той же менделеевской группы выравнивают свои радиусы, т. е. у элементов одной группы, разделённых по вертикали «лантанидным сжатием», Изоморфизм (химич.) становится весьма ярко выраженным. Это относится к парам Ba-Ra, Zr-Hf, Nb-Ta и др. Но как ни близки между собой Nb и Ta, их легче отделить друг от друга, чем отделить от Ti, с которым они связаны диагональным изоморфизмом. Таким образом, изовалентный Изоморфизм (химич.) представлен намного скромнее (во всяком случае количественно), чем гетеровалентный Изоморфизм (химич.) Возникает вопрос, как компенсировать в структуре кристалла изменение валентности, например её увеличение при Изоморфизм (химич.) Ca2+ ® Na1+. Решение просто, когда элемент на середине диагонали замещается двумя соседними по разные стороны, например 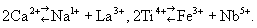
Особенно часто компенсация достигается за счёт одновременного гетеровалентного Изоморфизм (химич.) «в обратном направлении». В плагиоклазах замена Ca2+ на Na1+ сопровождается параллельно замещением Al3+ на Si4+: 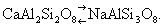 Возникает вопрос, как быть с радиусами Si4+(0,39
Возникает вопрос, как быть с радиусами Si4+(0,39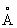 ) и Al3+(0,57
) и Al3+(0,57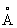 ), различающимися на 46%. Значительная разница между радиусами не является препятствием при гетеровалентном Изоморфизм (химич.), так как в анионной, более отрицательной части соединений заменяют друг друга не атомы, а тетраэдрические группы, например SiO4-4 и AlO5-4, в которых эффективные расстояния Si-О и Al-О (1,72 и 1,90
), различающимися на 46%. Значительная разница между радиусами не является препятствием при гетеровалентном Изоморфизм (химич.), так как в анионной, более отрицательной части соединений заменяют друг друга не атомы, а тетраэдрические группы, например SiO4-4 и AlO5-4, в которых эффективные расстояния Si-О и Al-О (1,72 и 1,90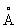 ) разнятся всего лишь на 9%. Литий, например, в более «катионной» форме, имеющий координацию 6, замещает по правилу диагонали Mg (в биотитах); находясь же среди четырёх О, способен заменить Be в берилле: [LiO4] ® [BeO4]. Разобранные закономерности касаются в основном случаев изоморфных замещений между полновалентными ионами типа «благородных газов» в соединениях, которые подчиняются законам элементарной энергетики (формулы А. Ф. Капустинского). Для переходных металлов, образующих соединения существенно ковалентного типа и стремящихся создать возле себя за счёт донорско-акцепторного механизма группы электронов 8, 13-14, 18, закономерности Изоморфизм (химич.) иные. Так, в случае пары элементов с одним и тем же радиусом, например Zn2+ и Fe2+, мы встречаемся с односторонним Изоморфизм (химич.) Цинк в своём главном соединении ZnS (сфалерит) допускает вхождение до 20% Fe, но Zn совершенно отсутствует в FeS. Причина лежит в возможности для Fe иметь как шестерную координацию, так и четверную, тогда как для Zn всегда в сульфидах - четверная координация.
) разнятся всего лишь на 9%. Литий, например, в более «катионной» форме, имеющий координацию 6, замещает по правилу диагонали Mg (в биотитах); находясь же среди четырёх О, способен заменить Be в берилле: [LiO4] ® [BeO4]. Разобранные закономерности касаются в основном случаев изоморфных замещений между полновалентными ионами типа «благородных газов» в соединениях, которые подчиняются законам элементарной энергетики (формулы А. Ф. Капустинского). Для переходных металлов, образующих соединения существенно ковалентного типа и стремящихся создать возле себя за счёт донорско-акцепторного механизма группы электронов 8, 13-14, 18, закономерности Изоморфизм (химич.) иные. Так, в случае пары элементов с одним и тем же радиусом, например Zn2+ и Fe2+, мы встречаемся с односторонним Изоморфизм (химич.) Цинк в своём главном соединении ZnS (сфалерит) допускает вхождение до 20% Fe, но Zn совершенно отсутствует в FeS. Причина лежит в возможности для Fe иметь как шестерную координацию, так и четверную, тогда как для Zn всегда в сульфидах - четверная координация.
Изоморфизм (химич.) очень распространён в природе. Широким развитием изоморфных замещений объясняется сложный химический состав большинства минералов, особенно из группы силикатов. Примером совершенного Изоморфизм (химич.) являются минералы переменного состава, дающие непрерывные ряды: плагиоклазы, скаполиты, вольфрамиты и др. Законы изоморфного замещения объясняют распределение редких элементов, находящихся в виде примесей в горных породах и рудах. Так, значительная часть иттрия и редких земель находится в апатите, сфене и флюорите, изоморфно замещая кальций; трёхвалентный ванадий замещает в магнетите окисное железо; селен - серу в пирите и т. д. Учение об Изоморфизм (химич.) является основой для изучения форм нахождения элементов в горных породах и процессов концентрации и рассеяния химических элементов в земной коре.
Лит.: Вернадский В. Изоморфизм (химич.), Очерки геохимии, 4 изд., М. - Л., 1934; Ферсман А. Е., Геохимия, 2 изд., т. 1, Л, 1934; Менделеев Д. Изоморфизм (химич.), Соч., т. 1, Л., 1937; Гольдшмидт В. М., Кристаллохимия, пер. с нем., Л., 1937; Сто лет периодического закона химических элементов, М., 1969.
Н. В. Белов.
| "БСЭ" >> "И" >> "ИЗ" >> "ИЗО" >> "ИЗОМ" |
Статья про "Изоморфизм (химич.)" в Большой Советской Энциклопедии была прочитана 974 раз
| Пицца в сковороде |
| Куриный суп |
TOP 20
- Лемке Михаил Константинович
- Сульфгидрильные группы
- «Казарменный коммунизм»
- Японское море
- Периодическая система элементов
- Глициния
- Башкирская Автономная Советская Социалистическая Республика
- Иммунитет (историч.)
- Объединённая партия гаитянских коммунистов
- Андаманское море
- Сенсуализм
- «Сообразительный»
- Балкано-кавказская раса
- Навигация (морск.)
- Звёздная астрономия
- Ямполь (пос. гор. типа в Донецкой обл.)
- Мандельштама - Бриллюэна рассеяние
- Кульчицкая Елена Львовна
- Театральные учебные заведения
- Электрическая постоянная