


БНБ
"БСЭ" (95279)
- Photogallery
- Естественные науки - Математика - Технология
- Авиация и машиностроение
- Высокие технологии
- Вычислительная техника
- Нанотехнология
- Роботехника
- Энергетика
- Электроника
Лёд
Определение "Лёд" в Большой Советской Энциклопедии
 |
| Структура льда (схема) |
 |
| Фазовая диаграмма воды |
| Свойство | Значение | Примечание |
| Теплоемкость, кал/(г··°C) Теплота таяния, кал/г
Теплота парообразования, кал/г | 0,51 (0°C) 79,69
677 | Сильно уменьшается с понижением температуры |
| Коэффициент термического расширения, 1/°C | 9,1·10—5 (0°C) |
|
| Теплопроводность, кал/(см сек··°C) | 4,99·10—3 | |
| Показатель преломления: для обыкновенного луча
для необыкновенного луча | 1,309 (—3°C)
1,3104 (—3°C) |
|
| Удельная электрическая проводимость, ом—1·см—1 |
| Кажущаяся энергия активации 11ккал/моль |
| Поверхностная электропроводность, ом—1 |
| Кажущаяся энергия активации 32ккал/моль |
| Модуль Юнга, дин/см | 9·1010 (—5°C) | Поликристаллич. лёд |
| Сопротивление, Мн/м2 : раздавливанию разрыву срезу | 2,5 1,11 0,57 | Поликристаллический лёд Поликристаллический лёд
Поликристаллический лёд |
| Средняя эффективная вязкость, пз | 1014 | Поликристаллический лёд |
| Показатель степени степенного закона течения | 3 |
|
| Энергия активации при деформировании и механической релаксации, ккал/моль |
| Линейно растет на 0,0361 ккал/(моль·°C) от 0 до 273,16 К |
Примечание. 1 кал/(г×°С)=4,186 кджl (kг (К); 1 ом-1×см-1=100 сим/м; 1 дин/см=10-3 н/м; 1 кал/(см (сек×°С)=418,68 вт/(м (К); 1 пз=10-1 н (сек/м2.
Табл. 2. — Количество, распространение и время жизни льда 1
| Вид льда | Масса | Площадь распространения | Средняя концен трация, г/см2 | Скорость прироста массы, г/год | Среднее время жизни, год | ||
| г | % | млн. км2 | % | ||||
| Ледники | 2,4·1022 | 98,95 | 16,1 | 10,9
суши | 1,48·105 | 2,5·1018 | 9580 |
| Подземный лёд | 2·1020 | 0,83 | 21 | 14,1
суши | 9,52·103 | 6·1018 | 30—75 |
| Морской лёд | 3,5·1019 | 0,14 | 26 | 7,2
океана | 1,34·102 | 3,3·1019 | 1,05 |
| Снежный покров | 1,0·1019 | 0,04 | 72,4 | 14,2
Земли | 14,5 | 2·1019 | 0.3—0,5 |
| Айсберги | 7,6·1018 | 0,03 | 63,5 | 18,7
океана | 14,3 | 1,9·1018 | 4,07 |
| Атмосферный лёд | 1,7·1018 | 0,01 | 510,1 | 100
Земли | 3,3·10—1 | 3,9·1020 | 4·10—3 |
В связи с широким распространением воды и Лёд на земной поверхности резкое отличие части свойств Лёд от свойств др. веществ играет важную роль в природных процессах. Вследствие меньшей, чем у воды, плотности Лёд образует на поверхности воды плавучий покров, предохраняющий реки и водоёмы от промерзания до дна. Зависимость между установившейся скоростью течения и напряжением у поликристаллического Лёд гиперболическая; при приближённом описании её степенным уравнением показатель степени увеличивается по мере роста напряжения; кроме того, скорость течения прямо пропорциональна энергии активации и обратно пропорциональна абсолютной температуре, так что с понижением температуры Лёд приближается к абсолютно твёрдому телу. В среднем при близкой к таянию температуре текучесть Лёд в 106 раз выше, чем у горных пород. Благодаря текучести Лёд не накопляется беспредельно, а стекает с тех частей земной поверхности, где его выпадает больше, чем стаивает (см. Ледники). Вследствие очень высокой отражательной способности Лёд (0,45) и особенно снега (до 0,95) покрытая ими площадь — в среднем за год около 72 млн. км2 в высоких и средних широтах обоих полушарий — получает солнечного тепла на 65% меньше нормы и является мощным источником охлаждения земной поверхности, чем в значительной мере обусловлена современная широтная климатическая зональность. Летом в полярных областях солнечная радиация больше, чем в экваториальном поясе, тем не менее температура остаётся низкой, т. к. значительная часть поглощаемого тепла затрачивается на таяние Лёд, имеющего очень высокую теплоту таяния.
Лёд II, III и V длительное время сохраняются при атмосферном давлении, если температура не превышает —170°С. При нагревании приблизительно до —150°С они превращаются в кубический Лёд (Лёд Ic), не показанный на диаграмме, т. к. неизвестно, является ли он стабильной фазой. Др. способ получения Лёд Ic — конденсация водяных паров на охлажденную до —120°С подложку. При конденсации паров на более холодной подложке образуется аморфный Лёд Обе эти формы Лёд могут самопроизвольно переходить в гексагональный Лёд I, причём тем скорее, чем выше температура.
Лёд IV является метастабильной фазой в зоне устойчивости Лёд V. Лёд IV легче образуется, а возможно и стабилен, если давлению подвергается тяжёлая вода. Кривая плавления льда VII исследована до давления 20 Гн/м2 (200 тыс. кгс/см2). При этом давлении Лёд VII плавится при температуре 400°С. Лёд VIII является низкотемпературной упорядоченной формой Лёд VII. Лёд IX — метастабильная фаза, возникающая при переохлаждении Лёд III и по существу представляющая собой низкотемпературную его форму. Вообще явления переохлаждения и метастабильные равновесия очень характерны для фаз, образуемых водой. Некоторые из линий метастабильных равновесий обозначены на диаграмме пунктиром.
Полиморфизм Лёд был обнаружен Г. Тамманом (1900) и подробно изучен П. Бриджменом (начиная с 1912). С 60-х гг. фазовая диаграмма воды, полученная Бриджменом, несколько раз дополнялась и уточнялась. В табл. 3 и 4 приведены некоторые данные о структурах модификаций Лёд и некоторые их свойства.
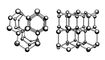
Кристаллы всех модификаций Лёд построены из молекул воды H2O, соединённых водородными связями в трёхмерный каркас (рис. 2). Каждая молекула участвует в 4 таких связях, направленных к вершинам тетраэдра. В структурах Лёд I, Ic, VII и VIII этот тетраэдр правильный, т. е. угол между связями составляет 109°28". Большая плотность Лёд VII и VIII объясняется тем, что их структуры содержат по 2 трёхмерные сетки водородных связей (каждая из которых идентична структуре Лёд Ic), вставленные одна в другую. В структурах Лёд II, III, V и VI тетраэдры заметно искажены. В структурах Лёд VI, VII и VIII можно выделить 2 взаимоперекрещивающиеся системы водородных связей. Данные о положениях протонов в структурах Лёд менее определенны, чем атомов кислорода. Можно утверждать, что конфигурация молекулы воды, характерная для пара, сохраняется и в твёрдом состоянии (по-видимому, несколько удлиняются расстояния О — Н вследствие образования водородных связей), а протоны тяготеют к линиям, соединяющим центры атомов кислорода. Т. о. возможны 6 более или менее эквивалентных ориентаций молекул воды относительно их соседей. Часть из них исключается, поскольку нахождение одновременно 2 протонов на одной водородной связи маловероятно, но остаётся достаточная неопределённость в ориентации молекул воды. Она осуществляется в большинстве модификаций Лёд — I, III, V, VI и VII (и по-видимому в Ic), так что, по выражению Дж. Бернала, Лёд кристалличен в отношении атомов кислорода и стеклообразен в отношении атомов водорода. Во Лёд II, VIII и IX молекулы воды ориентационно упорядочены.
Табл. 3. — Некоторые данные о структурах модификаций льда
| Модифи кация | Сингония | Фёдоровская группа | Длины водородных связей, 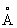 | Углы О—О—О в тетраэдрах |
| I Ic II III V VI VII VIII
IX | Гексагональная Кубическая Тригональная Тетрагональная Моноклинная Тетрагональная Кубическая Кубическая
Тетрагональная | P63/mmc F43m R3 P41212 A2/a P42/nmc Im3m Im3m
P41212 | 2,76 2,76 2,75—2,84 2,76—2,8 2,76—2,87 2,79—2,82 2,86 2,86
2,76—2,8 | 109,5 109,5 80—128 87—141 84—135 76—128 109,5 109,5 87—141 |
Примечание. 1 A=10-10 м.
Табл. 4. — Плотность и статическая диэлектрическая проницаемость различных льдов
| Модификация | Темп-ра, °С | Давление, Мн/м2 | Плотность, г/см2 | Диэлектрическая проницаемость |
| I Ic II III V VI VII VIII IX | 0 —130 —35 —22 —5 15 25 —50
—110 | 0,1 0,1 210 200 530 800 2500 2500
230 | 0,92 0,93 1,18 1,15 1,26 1,34 1,65 1,66
1,16 | 94 — 3,7 117 144 193 ~150 ~3 ~4 |
Лёд в атмосфере, в воде, на земной и водной поверхности и в земной коре оказывает большое влияние на условия обитания и жизнедеятельности растений и животных, на разные виды хозяйственной деятельности человека. Он может вызывать ряд стихийных явлений с вредными и разрушительными последствиями (обледенение летательных аппаратов, судов, сооружений, дорожного полотна и почвы, градобития, метели и снежные заносы, речные заторы и зажоры с наводнениями, ледяные обвалы, разрыв корней растений при образовании слоев Лёд в почве и др.). Прогнозирование, обнаружение, предотвращение вредных явлений, борьба с ними и использование Лёд в различных целях (снегозадержание, устройство ледяных переправ, изотермических складов, облицовка хранилищ, льдозакладка шахт и т.п.) представляют предмет ряда разделов гидрометеорологических и инженерно-технических знаний (ледотехника, снеготехника, инженерное мерзлотоведение и др.), деятельности специальных служб (ледовая разведка, ледокольный транспорт, снегоуборочная техника, искусственное сбрасывание лавин и т.д.). Для некоторых видов спорта используются катки с искусственным охлаждением, позволяющие проводить соревнования на Лёд в тёплое время года и в закрытом помещении. Природный Лёд используется для хранения и охлаждения пищевых продуктов, биологических и медицинских препаратов, для чего он специально производится и заготавливается (см. Ледник, Льдопроизводство).
Лит.: Шумский П. А., Основы структурного ледоведения, М., 1955; Паундер Э. Р., Физика льда, пер. с англ., М., 1967; Eisenberg D., Kauzmann W., The structure and properties of water, Oxf., 1969; Fletcher N. H., The chemical physics of ice, Camb., 1970.
Г. Г. Маленков.

Рис. 1. Фазовая диаграмма воды.
I (показаны атомы кислорода и направления водородных связей) в двух проекциях." href="/a_pictures/18/10/268737686.jpg">I (показаны атомы кислорода и направления водородных связей) в двух проекциях." src="a_pictures/18/10/th_268737686.jpg">
Рис. 2. Схема структуры льда I (показаны атомы кислорода и направления водородных связей) в двух проекциях.
| "БСЭ" >> "Л" >> "ЛЁ" |
Статья про "Лёд" в Большой Советской Энциклопедии была прочитана 1164 раз
| Бургер двойного помола |
| Каша со столетними яйцами |
TOP 20
- Лемке Михаил Константинович
- Сульфгидрильные группы
- «Казарменный коммунизм»
- Японское море
- Периодическая система элементов
- Глициния
- Башкирская Автономная Советская Социалистическая Республика
- Иммунитет (историч.)
- Андаманское море
- Объединённая партия гаитянских коммунистов
- Сенсуализм
- «Сообразительный»
- Балкано-кавказская раса
- Навигация (морск.)
- Звёздная астрономия
- Ямполь (пос. гор. типа в Донецкой обл.)
- Мандельштама - Бриллюэна рассеяние
- Кульчицкая Елена Львовна
- Театральные учебные заведения
- Электрическая постоянная