


БНБ
"БСЭ" (95279)
- Photogallery
- Естественные науки - Математика - Технология
- Авиация и машиностроение
- Высокие технологии
- Вычислительная техника
- Нанотехнология
- Роботехника
- Энергетика
- Электроника
Свинец
Определение "Свинец" в Большой Советской Энциклопедии
Свинец (лат. Plumbum), Pb, химический элемент IV группы периодической системы Менделеева; атомный номер 82, атомная масса 207,2. Свинец - тяжёлый металл голубовато-серого цвета, очень пластичный, мягкий (режется ножом, царапается ногтем). Природный Свинец состоит из 5 стабильных изотопов с массовыми числами 202 (следы), 204 (1,5%), 206 (23,6%), 207 (22,6%), 208 (52,3%). Последние три изотопа - конечные продукты радиоактивных превращений 238U, 235U и 232Th (см. Радиоактивные ряды). При ядерных реакциях образуются многочисленные радиоактивные изотопы Свинец Историческая справка. Свинец был известен за 6-7 тыс. лет до н. э. народам Месопотамии, Египта и других стран древнего мира. Он служил для изготовления статуй, предметов домашнего обихода, табличек для письма. Римляне пользовались свинцовыми трубами для водопроводов. Алхимики называли Свинец сатурном и обозначали его знаком этой планеты (см. Знаки химические). Соединения Свинец - «свинцовая зола» PbO, свинцовые белила 2PbCO3•Pb (OH)2 применялись в Древней Греции и Риме как составные части лекарств и красок. Когда было изобретено огнестрельное оружие, Свинец начали применять как материал для пуль. Ядовитость Свинец отметили ещё в 1 в. н. э. греческий врач Диоскорид и Плиний Старший, Распространение в природе. Содержание Свинец в земной коре (кларк) 1,6·10-3% по массе. Образование в земной коре около 80 минералов, содержащих Свинец (главный из них галенит PbS), связано в основном с формированием гидротермальных месторождений (см. Полиметаллические руды). В зонах окисления полиметаллических руд образуются многочисленные (около 90) вторичные минералы: сульфаты (англезит PbSO4), карбонаты (церуссит PbCO3), фосфаты [пироморфит Pb5(PO4)3Cl]. В биосфере Свинец в основном рассеивается, его мало в живом веществе (5·10-5%), морской воде (3·10-9%). Из природных вод Свинец отчасти сорбируется глинами и осаждается сероводородом, поэтому он накапливается в морских илах с сероводородным заражением и в образовавшихся из них чёрных глинах и сланцах, Физические и химические свойства. Свинец кристаллизуется в гранецентрированной кубической решётке (а = 4,9389 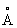 ), аллотропических модификаций не имеет. Атомный радиус 1,75
), аллотропических модификаций не имеет. Атомный радиус 1,75 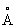 , ионные радиусы: Pb2+ 1,26
, ионные радиусы: Pb2+ 1,26 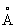 , Pb4+ 0,76
, Pb4+ 0,76 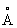 : плотность 11,34 г/см3 (20°С); tnл 327,4 °С; tkип 1725 °С; удельная теплоёмкость при 20°С 0,128 кдж/(кг·К) [0,0306 кал/г·°С]; теплопроводность 33,5 вт/(м·К)[0,08 кал/(см·сек·оС)]; температурный коэффициент линейного расширения 29,1·10-6 при комнатной температуре; твёрдость по Бринеллю 25-40 Мн/м2 (2,5-4 кгс/мм2); предел прочности при растяжении 12-13 Мн/м2, при сжатии около 50 Мн/м2; относительное удлинение при разрыве 50-70%. Наклёп не повышает механических свойств Свинец, т. к. температура его рекристаллизации лежит ниже комнатной (около -35 °С при степени деформации 40% и выше). Свинец диамагнитен, его магнитная восприимчивость - 0,12·10-6. При 7,18 К становится сверхпроводником.
: плотность 11,34 г/см3 (20°С); tnл 327,4 °С; tkип 1725 °С; удельная теплоёмкость при 20°С 0,128 кдж/(кг·К) [0,0306 кал/г·°С]; теплопроводность 33,5 вт/(м·К)[0,08 кал/(см·сек·оС)]; температурный коэффициент линейного расширения 29,1·10-6 при комнатной температуре; твёрдость по Бринеллю 25-40 Мн/м2 (2,5-4 кгс/мм2); предел прочности при растяжении 12-13 Мн/м2, при сжатии около 50 Мн/м2; относительное удлинение при разрыве 50-70%. Наклёп не повышает механических свойств Свинец, т. к. температура его рекристаллизации лежит ниже комнатной (около -35 °С при степени деформации 40% и выше). Свинец диамагнитен, его магнитная восприимчивость - 0,12·10-6. При 7,18 К становится сверхпроводником.
Конфигурация внешних электронных оболочек атома Pb 6s2 6р2, в соответствии с чем он проявляет степени окисления +2 и +4. Свинец сравнительно мало активен химически. Металлический блеск свежего разреза Свинец постепенно исчезает на воздухе вследствие образования тончайшей плёнки PbO, предохраняющей от дальнейшего окисления. С кислородом образует ряд окислов Pb2O, PbO, PbO2, Pb3O4 и Pb2O3 (см. Свинца окислы).
В отсутствие O2 вода при комнатной температуре на Свинец не действует, но он разлагает горячий водяной пар с образованием окиси Свинец и водорода. Соответствующие окислам PbO и PbO2 гидроокиси Pb (OH)2 и Pb (OH)4 имеют амфотерный характер.
Соединение Свинец с водородом PbH4 получается в небольших количествах при действии разбавленной соляной кислоты на Mg2Pb. PbH4 - бесцветный газ, который очень легко разлагается на Pb и H2. При нагревании Свинец соединяется с галогенами, образуя галогениды PbX2 (X - галоген). Все они малорастворимы в воде. Получены также галогениды PbX4: тетрафторид PbF4 - бесцветные кристаллы и тетрахлорид PbCl4 - жёлтая маслянистая жидкость. Оба соединения легко разлагаются, выделяя F2 или Cl2; гидролизуются водой. С азотом Свинец не реагирует. Азид свинца Pb (N3)2 получают взаимодействием растворов азида натрия NaN3 и солей Pb (II); бесцветные игольчатые кристаллы, труднорастворимые в воде; при ударе или нагревании разлагается на Pb и N2 со взрывом. Сера действует на Свинец при нагревании с образованием сульфида PbS - чёрного аморфного порошка. Сульфид может быть получен также при пропускании сероводорода в растворы солей Pb (II); в природе встречается в виде свинцового блеска - галенита.
В ряду напряжений Pb стоит выше водорода (нормальные электродные потенциалы соответственно равны - 0,126 в для Pb Û Pb2++ 2e и + 0,65 в для Pb Û Pb4++ 4e). Однако Свинец не вытесняет водород из разбавленной соляной и серной кислот, вследствие перенапряжения H2 на Pb, а также образования на поверхности металла защитных плёнок труднорастворимых хлорида PbCl2 и сульфата PbSO4. Концентрированные H2SO4 и HCl при нагревании действуют на Pb, причём получаются растворимые комплексные соединения состава Pb (HSO4)2 и H2[PbCl4]. Азотная, уксусная, а также некоторые органические кислоты (например, лимонная) растворяют Свинец с образованием солей Pb (II). По растворимости в воде соли делятся на растворимые (ацетат, нитрат и хлорат свинца), малорастворимые (хлорид и фторид) и нерастворимые (сульфат, карбонат, хромат, фосфат, молибдат и сульфид). Соли Pb (IV) могут быть получены электролизом сильно подкисленных H2SO4 растворов солей Pb (II); важнейшие из солей Pb (IV) - сульфат Pb (SO4)2 и ацетат Pb (C2H3O2)4. Соли Pb (IV) склонны присоединять избыточные отрицательные ионы с образованием комплексных анионов, например плюмбатов (PbO3)2- и (PbO4)4-, хлороплюмбатов (PbCl6)2-, гидроксоплюмбатов [Pb (OH)6]2- и др. Концентрированные растворы едких щелочей при нагревании реагируют с Pb с выделением водорода и гидроксоплюмбитов типа X2[Pb (OH)4].
Получение. Металлический Свинец получают окислительным обжигом PbS с последующим восстановлением PbO до сырого Pb («веркблея») и рафинированием (очисткой) последнего. Окислительный обжиг концентрата ведётся в агломерационных ленточных машинах непрерывного действия (см. Агломерация). При обжиге PbS преобладает реакция: 2PbS + 3O2 = 2PbO + 2SO2. Кроме того, получается и немного сульфата PbSO4, который переводят в силикат PbSiO3, для чего в шихту добавляют кварцевый песок. Одновременно окисляются и сульфиды других металлов (Cu, Zn, Fe), присутствующие как примеси. В результате обжига вместо порошкообразной смеси сульфидов получают агломерат - пористую спекшуюся сплошную массу, состоящую преимущественно из окислов PbO, CuO, ZnO, Fe2O3. Куски агломерата смешивают с коксом и известняком и эту смесь загружают в ватержакетную печь, в которую снизу через трубы («фурмы») подают воздух под давлением. Кокс и окись углерода восстанавливают PbO до Pb уже при невысоких температурах (до 500 °С). При более высоких температурах идут реакции:
2PbSiO3 + 2CaO + С = 2Pb + 2CaSiO3 + CO2.
Окислы Zn и Fe частично переходят в ZnSiO3 и FeSiO3, которые вместе с CaSiO3 образуют шлак, всплывающий на поверхность. Окислы Свинец восстанавливаются до металла. Сырой Свинец содержит 92-98% Pb, остальное - примеси Cu, Ag (иногда Au), Zn, Sn, As, Sb, Bi, Fe. Примеси Cu и Fe удаляют зейгерованием. Для удаления Sn, As, Sb через расплавленный металл продувают воздух. Выделение Ag (и Au) производится добавкой Zn, который образует «цинковую пену», состоящую из соединений Zn c Ag (и Au), более лёгких, чем Pb, и плавящихся при 600-700 °Свинец Избыток Zn удаляют из расплавленного Pb пропусканием воздуха, водяного пара или хлора. Для очистки от Bi к жидкому Pb добавляют Ca или Mg, дающие трудноплавкие соединения Ca3Bi2 и Mg3Bi2. Рафинированный этими способами Свинец содержит 99,8-99,9% Pb. Дальнейшая очистка производится электролизом, в результате чего достигается чистота не менее 99,99%. Применение. Свинец широко применяют в производстве свинцовых аккумуляторов, используют для изготовления заводской аппаратуры, стойкой в агрессивных газах и жидкостях. Свинец сильно поглощает g-лучи и рентгеновские лучи, благодаря чему его применяют как материал для защиты от их действия (контейнеры для хранения радиоактивных веществ, аппаратура рентгеновских кабинетов и др.). Большие количества Свинец идут на изготовление оболочек электрических кабелей, защищающих их от коррозии и механических повреждений. На основе Свинец изготовляют многие свинцовые сплавы. Окись Свинец PbO вводят в хрусталь и оптическое стекло для получения материалов с большим показателем преломления. Сурик, хромат (жёлтый крон) и основной карбонат Свинец (свинцовые белила) - ограниченно применяемые пигменты. Хромат Свинец - окислитель, используется в аналитической химии. Азид и стифнат (тринитрорезорцинат) - инициирующие взрывчатые вещества. Тетраэтилсвинец - антидетонатор. Ацетат Свинец служит индикатором для обнаружения H2S. В качестве изотопных индикаторов используются 204Pb (стабильный) и 212Pb (радиоактивный).
Свинец А. Погодин.
Свинец в организме. Растения поглощают Свинец из почвы, воды и атмосферных выпадений. В организм человека Свинец попадает с пищей (около 0,22 мг), водой (0,1 мг), пылью (0,08 мг). Безопасный суточный уровень поступления Свинец для человека 0,2-2 мг. Выделяется главным образом с калом (0,22-0,32 мг), меньше с мочой (0,03-0,05 мг). В теле человека содержится в среднем около 2 мг Свинец (в отдельных случаях - до 200 мг). У жителей промышленно развитых стран содержание Свинец в организме выше, чем у жителей аграрных стран, у горожан выше, чем у сельских жителей. Основное депо Свинец - скелет (90% всего Свинец организма): в печени накапливается 0,2-1,9 мкг/г; в крови - 0,15-0,40 мкг/мл; в волосах - 24 мкг/г, в молоке -0,005-0,15 мкг/мл; содержится также в поджелудочной железе, почках, головном мозге и др. органах. Концентрация и распределение Свинец в организме животных близки к показателям, установленным для человека. При повышении уровня Свинец в окружающей среде возрастает его отложение в костях, волосах, печени. Биологические функции Свинец не установлены.
Ю. И. Раецкая.
Отравления Свинец и его соединениями возможны при добыче руд, выплавке Свинец, при производстве свинцовых красок, в полиграфии, гончарном, кабельном производствах, при получении и применении тетраэтилсвинца и др. Бытовые отравления возникают редко и наблюдаются при употреблении в пищу продуктов, которые длительно хранили в глиняной посуде, покрытой глазурью, содержащей свинцовый сурик или глёт. Свинец и его неорганические соединения в виде аэрозолей проникают в организм в основном через дыхательные пути, в меньшей степени - через желудочно-кишечный тракт и кожу. В крови Свинец циркулирует в виде высокодисперсных коллоидов - фосфата и альбумината. Выделяется Свинец в основном через кишечник и почки. В развитии интоксикации играют роль нарушение порфиринового, белкового, углеводного и фосфатного обменов, дефицит витаминов С и B1, функциональные и органические изменения центральной и вегетативной нервной системы, токсическое влияние Свинец на костный мозг. Отравления могут быть скрытыми (т. н. носительство), протекать в лёгкой, средней тяжести и тяжёлой формах.
Наиболее частые признаки отравления Свинец: кайма (полоска лиловато-аспидного цвета) по краю дёсен, землисто-бледная окраска кожных покровов; ретикулоцитоз и другие изменения крови, повышенное содержание порфиринов в моче, наличие в моче Свинец в количествах 0,04-0,08 мг/л и более и т. д. Поражение нервной системы проявляется астенией, при выраженных формах - энцефалопатией, параличами (преимущественно разгибателей кисти и пальцев рук), полиневритом. При т. н. свинцовой колике возникают резкие схваткообразные боли в животе, запор, продолжающиеся от нескольких ч до 2-3 нед; нередко колика сопровождается тошнотой, рвотой, подъёмом артериального давления, температуры тела до 37,5-38 °Свинец При хронической интоксикации возможны поражения печени, сердечно-сосудистой системы, нарушение эндокринных функций (например, у женщин - выкидыши, дисменорея, меноррагии и др.). Угнетение иммунобиологической реактивности способствует повышенной общей заболеваемости.
Лечение: специфические (комплексонообразователи и др.) и общеукрепляющие (глюкоза, витамины и др.) средства, физиотерапия, санаторно-курортное лечение (Пятигорск, Мацеста, Серноводск). Профилактика: замена Свинец менее токсичными веществами (например, цинковые и титановые белила вместо свинцовых), автоматизация и механизация операций в производстве Свинец, эффективная вытяжная вентиляция, индивидуальная защита рабочих, лечебное питание, периодическая витаминизация, предварительные и периодические медицинские осмотры.
Препараты Свинец используют в медицинской практике (только наружно) как вяжущие и антисептические средства. Применяют: свинцовую воду (при воспалительных заболеваниях кожи и слизистых оболочек), простой и сложный свинцовые пластыри (при гнойно-воспалительных заболеваниях кожи, фурункулах) и др.
Л. А. Каспаров.
Лит.: Андреев В. М., Свинец, в кн.: Краткая химическая энциклопедия, т. 4, М., 1965; Реми Г., Курс неорганической химии, пер. с нем., т. 1, М., 1963; Чижиков Д. М., Металлургия свинца, в кн.: Справочник металлурга по цветным металлам, т. 2, М., 1947; Вредные вещества в промышленности, под ред. Н. В. Лазарева, 6 изд., ч. 2, Л., 1971; Тарабаева Г. И., Действие свинца на организм и лечебно-профилактические мероприятия, А.-А., 1961; Профессиональные болезни, 3 изд., М., 1973,
| "БСЭ" >> "С" >> "СВ" >> "СВИ" |
Статья про "Свинец" в Большой Советской Энциклопедии была прочитана 636 раз
| Коптим скумбрию в коробке |
| Английская картошка фри |
TOP 20
- Лемке Михаил Константинович
- Сульфгидрильные группы
- «Казарменный коммунизм»
- Глициния
- Японское море
- Периодическая система элементов
- Башкирская Автономная Советская Социалистическая Республика
- Иммунитет (историч.)
- Андаманское море
- Сенсуализм
- «Сообразительный»
- Звёздная астрономия
- Балкано-кавказская раса
- Ямполь (пос. гор. типа в Донецкой обл.)
- Навигация (морск.)
- Кульчицкая Елена Львовна
- Мандельштама - Бриллюэна рассеяние
- Театральные учебные заведения
- Электрическая постоянная
- Энсор Джеймс