


БНБ
"БСЭ" (95279)
- Photogallery
- Естественные науки - Математика - Технология
- Авиация и машиностроение
- Высокие технологии
- Вычислительная техника
- Нанотехнология
- Роботехника
- Энергетика
- Электроника
Бензол
Определение "Бензол" в Большой Советской Энциклопедии
 |
| Бензол |
 |
| Бензол |
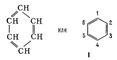
В 1865 Ф. А. Кекуле предложил для Бензол формулу строения I, соответствующую циклогексатриену - замкнутую цепь из 6 атомов углерода с чередующимися простыми и двойными связями. Формулой Кекуле довольно широко пользуются, хотя накоплено много фактов, свидетельствующих о том, что Бензол не обладает строением циклогексатриена. Так, давно установлено, что орто-дизамещённые Бензол (например, 1,2 и 1,6) существуют лишь в одной форме, тогда как формула Кекуле допускает изомерию таких соединений (заместители у атомов углерода, связанных простой или двойной связью). В 1872 Кекуле дополнительно ввёл гипотезу о том, что связи в Бензол постоянно и очень быстро перемещаются, осциллируют. Были предложены и др. формулы строения Бензол, однако они не получили признания.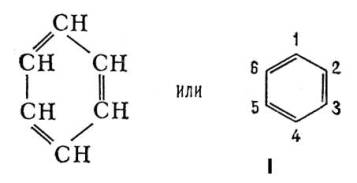
Химические свойства Бензол формально в некоторой степени соответствуют формуле (1). Так, в определённых условиях к молекуле Бензол присоединяются 3 молекулы хлора или 3 молекулы водорода; Бензол образуется при конденсации 3 молекул ацетилена. Однако для Бензол характерны в основном не реакции присоединения, типичные для ненасыщенных соединений, а реакции электрофильного замещения. Кроме того, бензольное ядро очень устойчиво к действию окислителей, например перманганата калия, что также противоречит наличию в Бензол локализованных двойных связей. Особые, т. н. ароматические, свойства Бензол объясняются тем, что все связи в его молекуле выравнены, т. е. расстояния между соседними атомами углерода одинаковы и равны 0,14 нм (1,40 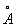 ), длина простой связи С-С 0,154 нм (1,54
), длина простой связи С-С 0,154 нм (1,54 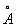 ) и двойной С = С 0,132 нм (1,32
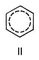
) и двойной С = С 0,132 нм (1,32 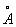 ). Молекула Бензол имеет ось симметрии шестого порядка; для Бензол как ароматического соединения характерно наличие секстета p-электронов, образующих единую замкнутую устойчивую электронную систему. Однако до сих пор нет общепринятой формулы, отражающей его строение; часто используют формулу II.
). Молекула Бензол имеет ось симметрии шестого порядка; для Бензол как ароматического соединения характерно наличие секстета p-электронов, образующих единую замкнутую устойчивую электронную систему. Однако до сих пор нет общепринятой формулы, отражающей его строение; часто используют формулу II.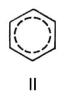
Бензол содержится в продуктах сухой перегонки каменного угля (коксовом газе) и небольшое количество - в коксовой смоле. Значительные количества Бензол получают также каталитической циклизацией алифатических углеводородов нефти (см. Ароматизация нефтепродуктов). Бензол - важнейшее сырьё химической промышленности. При действии азотной кислоты на Бензол образуется нитробензол С6Н5NО2, который может быть восстановлен в анилин C6H5NH2 - исходный продукт в производстве многих красителей. При взаимодействии Бензол с серной кислотой получается бензолсульфокислота C6H5SO2OH, щелочное плавление солей которой - один из основных методов производства фенола. При алкилировании Бензол этиленом в присутствии хлористого алюминия получается этилбензол, каталитическое дегидрирование которого представляет собой основной способ производства стирола C6H5CH=CH2. Аналогично из Бензол и пропилена образуется изопропилбензол C6H5CH (CH3)2 - исходный продукт для получения фенола и ацетона в промышленном масштабе. Широко применяют и галогенопроизводные Бензол Так, хлорбензол омыляется в фенол; из хлорбензола и магния Гриньяра реакцией получают фенилмагнийхлорид C6H5MgCI, при реакции которого с окисью этилена образуется b-фенилэтиловый спирт C6H5CH2CH2OH, используемый в парфюмерии как искусственное розовое масло. При каталитическом гидрировании Бензол превращается в циклогексан - исходный продукт в одном из способов производства капролактама, полимеризацией которого получают синтетическое волокно «капрон». При облучении Бензол присоединяет 3 моля хлора с образованием смеси стереоизомерных гексахлорциклогексанов, один из которых (гексахлоран) обладает сильными инсектицидными свойствами. Бензол применяют в производстве взрывчатых веществ, а также как растворитель и экстрагирующее средство в производстве лаков, красок и др.
Лит.: Неницеску К. Д., Органическая химия, пер. с рум., т. 1, М., 1962, с. 304, 323.
Я. Ф. Комиссаров.
Действие на организм. Бензол может вызывать острые и хронические отравления. Проникает в организм главным образом через органы дыхания, может всасываться и через неповрежденную кожу. Предельно допустимая концентрация паров Бензол в воздухе рабочих помещений 20 мг/м3. Выводится через лёгкие и с мочой. Острые отравления происходят обычно при авариях; их наиболее характерные признаки: головная боль, головокружение, тошнота, рвота, возбуждение, сменяющееся угнетённым состоянием, частый пульс, падение кровяного давления, в тяжёлых случаях - судороги, потеря сознания. Хроническое отравление Бензол проявляется изменением крови (нарушение функции костного мозга), головокружением, общей слабостью, расстройством сна, быстрой утомляемостью; у женщин - нарушением менструальной функции. Надёжная мера против отравлений парами Бензол - хорошая вентиляция производственных помещений.
Лечение при острых отравлениях: покой, тепло, бромистые препараты, сердечно-сосудистые средства; при хронических отравлениях с выраженной анемией: переливание эритроцитарной массы, витамин B12, препараты железа.
Лит.: Омельяненко Л. М. и Сенкевич Н. А., Клиника и профилактика отравлений бензолом, М., 1957; Профессиональные болезни, 2 изд., М., 1964.
| "БСЭ" >> "Б" >> "БЕ" >> "БЕН" >> "БЕНЗ" |
Статья про "Бензол" в Большой Советской Энциклопедии была прочитана 1303 раз
| Коптим скумбрию в коробке |
| Каракатица на гриле |
TOP 20
- Лемке Михаил Константинович
- Сульфгидрильные группы
- «Казарменный коммунизм»
- Японское море
- Периодическая система элементов
- Глициния
- Башкирская Автономная Советская Социалистическая Республика
- Иммунитет (историч.)
- Андаманское море
- Сенсуализм
- Объединённая партия гаитянских коммунистов
- «Сообразительный»
- Балкано-кавказская раса
- Навигация (морск.)
- Звёздная астрономия
- Ямполь (пос. гор. типа в Донецкой обл.)
- Мандельштама - Бриллюэна рассеяние
- Кульчицкая Елена Львовна
- Театральные учебные заведения
- Электрическая постоянная