


БНБ
"БСЭ" (95279)
- Photogallery
- Естественные науки - Математика - Технология
- Авиация и машиностроение
- Высокие технологии
- Вычислительная техника
- Нанотехнология
- Роботехника
- Энергетика
- Электроника
Теплоёмкость
Определение "Теплоёмкость" в Большой Советской Энциклопедии
Теплоёмкость, количество теплоты, поглощаемой телом при нагревании на 1 градус; точнее - отношение количества теплоты, поглощаемой телом при бесконечно малом изменении его температуры, к этому изменению Теплоёмкость единицы массы вещества (г, кг) называется удельной теплоёмкостью, 1 моля вещества - мольной (молярной) Теплоёмкость
Количество теплоты, поглощённой телом при изменении его состояния, зависит не только от начального и конечного состояний (в частности, от их температуры), но и от способа, которым был осуществлен процесс перехода между ними. Соответственно от способа нагревания тела зависит и его Теплоёмкость Обычно различают Теплоёмкость при постоянном объёме (Cv) и Теплоёмкость при постоянном давлении (Ср), если в процессе нагревания поддерживаются постоянными соответственно его объём или давление. При нагревании при постоянном давлении часть теплоты идёт на производство работы расширения тела, а часть - на увеличение его внутренней энергии, тогда как при нагревании при постоянном объёме вся теплота расходуется только на увеличение внутренней энергии; в связи с этим cp всегда больше, чем cv. Для газов (разреженных настолько, что их можно считать идеальными) разность мольных Теплоёмкость равна cp - cv = R, где R - универсальная газовая постоянная, равная 8,314 дж/(моль× К), или 1,986 кал/(моль× град). У жидкостей и твёрдых тел разница между Ср и Cv сравнительно мала.
Теоретическое вычисление Теплоёмкость, в частности её зависимости от температуры тела, не может быть осуществлено с помощью чисто термодинамических методов и требует применения методов статистической физики. Для газов вычисление Теплоёмкость сводится к вычислению средней энергии теплового движения отдельных молекул. Это движение складывается из поступательного и вращательного движений молекулы как целого и из колебаний атомов внутри молекулы. Согласно классической статистике (то есть статистической физике, основанной на классической механике), на каждую степень свободы поступательного и вращательного движений приходится в мольной Теплоёмкость (Cv) газа величина, равная. R /2; а на каждую колебательную степень свободы - R, это правило называется равнораспределения законом. Частица одноатомного газа обладает всего тремя поступательными степенями свободы, соответственно чему его Теплоёмкость должна составлять 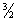 R [то есть около 12,5 дж/Кмоль× К), или 3 кал/(моль×град)], что хорошо согласуется с опытом. Молекула двухатомного газа обладает тремя поступательными, двумя вращательными и одной колебательной степенями свободы, и закон равнораспределения приводит к значению Cv =
R [то есть около 12,5 дж/Кмоль× К), или 3 кал/(моль×град)], что хорошо согласуется с опытом. Молекула двухатомного газа обладает тремя поступательными, двумя вращательными и одной колебательной степенями свободы, и закон равнораспределения приводит к значению Cv = 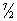 R; между тем опыт показывает, что Теплоёмкость двухатомного газа (при обычных температурах) составляет всего
R; между тем опыт показывает, что Теплоёмкость двухатомного газа (при обычных температурах) составляет всего 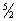 R. Это расхождение теории с экспериментом связано с тем, что при вычислении Теплоёмкость необходимо учитывать квантовые эффекты, то есть пользоваться статистикой, основанной на квантовой механике. Согласно квантовой механике, всякая система частиц, совершающих колебания или вращения (в том числе молекула газа), может обладать лишь определёнными дискретными значениями энергии. Если энергия теплового движения в системе недостаточна для возбуждения колебаний определённой частоты, то эти колебания не вносят своего вклада в Теплоёмкость системы (соответствующая степень свободы оказывается «замороженной» - к ней неприменим закон равнораспределения). Температура Т, при достижении которой закон равнораспределения оказывается применимым к вращательной или колебательной степени свободы, определяется квантово-механическим соотношением T >> hv/k (v - частота колебаний, h - Планка постоянная, k - Больцмана постоянная). Интервалы между вращательными уровнями энергии двухатомной молекулы (деленные на k) составляют всего несколько градусов и лишь для такой лёгкой молекулы, как молекула водорода, достигают сотни градусов. Поэтому при обычных температурах вращательная часть Теплоёмкость двухатомных (а также многоатомных) газов подчиняется закону равнораспределения. Интервалы же между колебательными уровнями энергии достигают нескольких тысяч градусов и поэтому при обычных температурах закон равнораспределения совершенно неприменим к колебательной части Теплоёмкость Вычисление Теплоёмкость по квантовой статистике приводит к тому, что колебательная Теплоёмкость быстро убывает при понижении температуры, стремясь к нулю. Этим объясняется то обстоятельство, что уже при обычных температурах колебательная часть Теплоёмкость практически отсутствует и Теплоёмкость двухатомного газа равна
R. Это расхождение теории с экспериментом связано с тем, что при вычислении Теплоёмкость необходимо учитывать квантовые эффекты, то есть пользоваться статистикой, основанной на квантовой механике. Согласно квантовой механике, всякая система частиц, совершающих колебания или вращения (в том числе молекула газа), может обладать лишь определёнными дискретными значениями энергии. Если энергия теплового движения в системе недостаточна для возбуждения колебаний определённой частоты, то эти колебания не вносят своего вклада в Теплоёмкость системы (соответствующая степень свободы оказывается «замороженной» - к ней неприменим закон равнораспределения). Температура Т, при достижении которой закон равнораспределения оказывается применимым к вращательной или колебательной степени свободы, определяется квантово-механическим соотношением T >> hv/k (v - частота колебаний, h - Планка постоянная, k - Больцмана постоянная). Интервалы между вращательными уровнями энергии двухатомной молекулы (деленные на k) составляют всего несколько градусов и лишь для такой лёгкой молекулы, как молекула водорода, достигают сотни градусов. Поэтому при обычных температурах вращательная часть Теплоёмкость двухатомных (а также многоатомных) газов подчиняется закону равнораспределения. Интервалы же между колебательными уровнями энергии достигают нескольких тысяч градусов и поэтому при обычных температурах закон равнораспределения совершенно неприменим к колебательной части Теплоёмкость Вычисление Теплоёмкость по квантовой статистике приводит к тому, что колебательная Теплоёмкость быстро убывает при понижении температуры, стремясь к нулю. Этим объясняется то обстоятельство, что уже при обычных температурах колебательная часть Теплоёмкость практически отсутствует и Теплоёмкость двухатомного газа равна 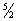 R вместо
R вместо 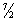 R.
R.
При достаточно низких температурах Теплоёмкость вообще должна вычисляться с помощью квантовой статистики. Как оказывается, Теплоёмкость убывает с понижением температуры, стремясь к нулю при Т ® 0 в согласии с так называемом принципом Нернста (третьим началом термодинамики).
В твёрдых (кристаллических) телах тепловое движение атомов представляет собой малые колебания вблизи определённых положений равновесия (узлов кристаллической решётки). Каждый атом обладает, таким образом, тремя колебательными степенями свободы и, согласно закону равнораспределения, мольная Теплоёмкость твёрдого тела (Теплоёмкость кристаллической решётки) должна быть равной 3 nR, где n - число атомов в молекуле. В действительности, однако, это значение - лишь предел, к которому стремятся Теплоёмкость твёрдого тела при высоких температурах. Он достигается уже при обычных температурах у многих элементов, в том числе металлов (n = 1, так называемый Дюлонга и Пти закон) и у некоторых простых соединений [NaCI, MnS (n = 2), PbCl2 (n = 3) и др.]; у сложных соединений этот предел фактически никогда не достигается, т. к. ещё раньше наступает плавление вещества или его разложение.
Квантовая теория Теплоёмкость твёрдых тел была развита А. Эйнштейном (1907) и П. Дебаем (1912). Она основана на квантовании колебательного движения атомов в кристалле. При низких температурах Теплоёмкость твёрдого тела оказывается пропорциональной кубу абсолютной температуры (так называемый закон Дебая). Критерием, позволяющим различать высокие и низкие температуры, является сравнение с характерным для каждого данного вещества параметром - так называемой характеристической, или дебаевской, температурой QD. Эта величина определяется спектром колебаний атомов в теле и, тем самым, существенно зависит от его кристаллической структуры. Обычно QD - величина порядка нескольких сот К, но может достигать (например, у алмаза) и тысяч К (см. Дебая температура).
У металлов определённый вклад в Теплоёмкость дают также и электроны проводимости. Эта часть Теплоёмкость может быть вычислена с помощью квантовой статистики Ферми, которой подчиняются электроны. Электронная Теплоёмкость металла пропорциональна первой степени абсолютной температуры. Она представляет собой, однако, сравнительно малую величину, её вклад в Теплоёмкость становится существенным лишь при температурах, близких к абсолютному нулю (порядка нескольких градусов), когда обычная Теплоёмкость, связанная с колебаниями атомов кристаллической решётки, представляет собой ещё меньшую величину.
Ниже приводятся значения Теплоёмкость [ккал/(кг× град)] некоторых газов, жидкостей и твёрдых тел при температуре 0 °С и атмосферном давлении (1 ккал = 4,19кдж).
Азот.………………6,8 Свинец…………….0,030
Водород …………6,84 Кварц ……………..0,174
Железо…………..0,104 Спирт этиловый…0,547
Медь……………...0,091 Алюминий ……….0,210
Вода.……….…….1,008
Лит.: Кикоин И. К., Кикоин А. К,, Молекулярная физика, М., 1963; Ландау Л. Д., Лифшиц Е. М., Статистическая физика, 2 изд., М., 1964 (Теоретическая физика, т. 5).
Е. М. Лифшиц.
| "БСЭ" >> "Т" >> "ТЕ" >> "ТЕП" >> "ТЕПЛ" |
Статья про "Теплоёмкость" в Большой Советской Энциклопедии была прочитана 1234 раз
| Бургер двойного помола |
| Яйца в кляре |
TOP 20
- Лемке Михаил Константинович
- Сульфгидрильные группы
- «Казарменный коммунизм»
- Японское море
- Периодическая система элементов
- Глициния
- Башкирская Автономная Советская Социалистическая Республика
- Иммунитет (историч.)
- Андаманское море
- Сенсуализм
- «Сообразительный»
- Балкано-кавказская раса
- Навигация (морск.)
- Звёздная астрономия
- Ямполь (пос. гор. типа в Донецкой обл.)
- Кульчицкая Елена Львовна
- Мандельштама - Бриллюэна рассеяние
- Театральные учебные заведения
- Электрическая постоянная
- Энсор Джеймс