


БНБ
"БСЭ" (95279)
- Photogallery
- Естественные науки - Математика - Технология
- Авиация и машиностроение
- Высокие технологии
- Вычислительная техника
- Нанотехнология
- Роботехника
- Энергетика
- Электроника
Фосфаты
Определение "Фосфаты" в Большой Советской Энциклопедии
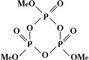 |
| Фосфаты |
Ортофосфаты – соли ортофосфорной кислоты H3PO4 – известны одно-, двух- и трёхзамещённые. Однозамещённые ортофосфаты, содержащие анион H2PO4, растворимы в воде, из двух- и трёхзамещённых ортофосфатов, содержащих соответственно анионы HPO42- и PO43-, растворимы только соли щелочных металлов и аммония. Трёхзамещённые ортофосфаты, за исключением триаммоний фосфата (NH4)3PO4×3H2O, термически устойчивы; трикальцийфосфат заметно диссоциирует лишь при температурах выше 2000 °С (диссоциация улучшается под вакуумом): Ca3(PO4)2 = 3CaO + P2O5. При нагревании одно- и двухзамещённых ортофосфатов происходит их дегидратация с выделением структурной воды и образованием полимерных (линейных или кольцевых) фосфатов по схеме:
(n-2) MeH2PO4 (2Me2HPO4 (Men + 2PnO3n + 1 + (n-1) H2O
(где n – степень полимеризации).
Все встречающиеся в природе соединения фосфора представляют собой ортофосфаты (см. Фосфаты природные). В промышленности растворимые в воде ортофосфаты получают по следующей схеме: 1) производство из природных Фосфаты (главным образом апатитов) ортофосфорной кислоты (см. Фосфорные кислоты); 2) взаимодействие ортофосфорной кислоты с гидроокисями, аммиаком, хлоридами или карбонатами, например:
Труднорастворимые ортофосфаты тяжелых металлов (например, Ag, Cu) образуются в результате обменных реакций, например:
2Na2HPO4 + 3AgNO3 = Ag3PO4 + 3NaNO3 + NaH2PO4
Полимерные Фосфаты различных структурных типов могут быть описаны формулами: линейные полифосфаты Men + 2PnO3n + 1, или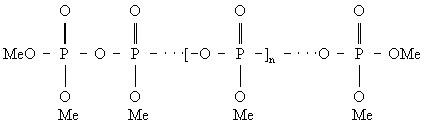
кольцевые метафосфаты MenPnO3n, или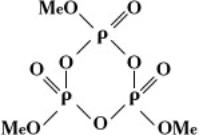
(где n – степень полимеризации).
Свойства полимерных Фосфаты зависят от характера катиона, строения фосфат-аниона, степени полимеризации, структуры фосфата и др. Так, например, растворимость линейных полифосфатов, как правило, падает с увеличением степени полимеризации, но может быть увеличена путём модифицирования полифосфатов, например изменением скорости охлаждения расплава.
Получают полимерные Фосфаты (линейные и кольцевые) в основном термической дегидратацией одно- и двухзамещённых ортофосфатов или нейтрализацией соответствующих поли- или мета- (циклических) фосфорных кислот:
Hn + 2PnO3n + 1 + nNH3 = (NH4) n H2PnO3n + 1
(иногда эти процессы совмещаются, как, например, при высокотемпературной аммонизации ортофосфорной кислоты для получения полифосфатов аммония). В промышленных масштабах эти способы используют для получения пиро-, триполифосфатов натрия (соответственно Na4P2O7, Na5P3O10) и в меньшей степени – калия, а также полимерных метафосфатов (натрий-фосфатные стекла, метафосфат калия и др.).
Из циклических метафосфатов наиболее изучены тримета-, тетрамета-, гексамета- и октаметафосфаты.
Ультрафосфаты – соединения общей формулы MenRPnOn (5 + R)/2, где R = Me2O/P2O5, как правило, аморфные, стеклообразные вещества, гигроскопичные, легко гидролизующиеся на воздухе с образованием поли- и метафосфатов. Последние в присутствии большого количества воды могут гидролизоваться за счёт полного расщепления Р–О–Р-связей вплоть до ортофосфатов. Выделенные в кристаллическом виде ультрафосфаты кальция, магния, марганца и некоторых лантаноидов, как правило, не гигроскопичны. Ультрафосфаты образуются в результате термической дегидратации смеси ортофосфатов с фосфорными кислотами или с фосфорным ангидридом, т. е. при наличии условия
О < Me2O/P2O5 < 1.
Фосфаты кальция, аммония, калия и др. широко применяются в качестве фосфорных удобрений. В 70-е гг. 20 в. выросло производство кормовых фосфатов [например, обесфторенные Фосфаты, преципитат, динатрийфосфат, фосфаты мочевины – H3PO4×(NH2)2CO и др.]. Фосфаты натрия и калия (особенно триполифосфаты) применяют в качестве компонентов жидких и порошкообразных моющих средств и поверхностно-активных веществ при буровых работах, в цементной, текстильной промышленности при подготовке шерсти, хлопка к белению и крашению. Фосфаты используют в пищевой промышленности в качестве рыхлителей теста, например (NH4)2HPO4. Некотоpые Фосфаты (например, BPO4) применяют в качестве катализаторов в реакциях органического синтеза. Фосфаты преимущественно щелочных металлов входят в состав эмалей, глазурей, стекол, огнестойких материалов (как антипирены), а также мягких абразивов; они используются при фосфатировании металлов (Mg, Fe, Zn). Кристаллы однозамещённых фосфатов калия, аммония применяются как сегнетоэлектрики и пьезоэлектрические материалы. Фосфаты используются в фармацевтической промышленности при изготовлении лекарственных препаратов (например, фосфакол, АТФ – аденозинтрифосфат и др.), зубных паст и порошков.
Л. В. Кубасова.
Из эфиров фосфорных кислот наиболее известны одно-, двух- и трёхзамещённые ортофосфаты, соответственно ROP (O)(OH)2, (RO)2P (O) OH и (KO)3PO (где R – алкил, арил или гетероциклический остаток). Получаются при взаимодействии POCl3 со спиртами:
POCl3 + 2ROH ® (RO)2P (O) Cl 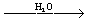 (RO)2P (O) OH
(RO)2P (O) OH
и др. способами.
Применяются как пестициды, присадки к маслам, экстрагенты и т.д. Некоторые органические Фосфаты (нуклеиновые кислоты, аденозинфосфорные кислоты) выполняют важные функции в живых организмах.
Э. Е. Нифантьев.
Лит.: Продан Е. А., Продан Л. И., Ермоленко Н. Фосфаты, Триполифосфаты и их применение, Минск, 1969; см. также лит. при ст. Фосфор.
| "БСЭ" >> "Ф" >> "ФО" >> "ФОС" |
Статья про "Фосфаты" в Большой Советской Энциклопедии была прочитана 697 раз
| Коптим скумбрию в коробке |
| Шотландский Стовис |
TOP 20
- Лемке Михаил Константинович
- Сульфгидрильные группы
- «Казарменный коммунизм»
- Японское море
- Периодическая система элементов
- Глициния
- Башкирская Автономная Советская Социалистическая Республика
- Иммунитет (историч.)
- Андаманское море
- Объединённая партия гаитянских коммунистов
- Сенсуализм
- «Сообразительный»
- Балкано-кавказская раса
- Навигация (морск.)
- Звёздная астрономия
- Ямполь (пос. гор. типа в Донецкой обл.)
- Мандельштама - Бриллюэна рассеяние
- Кульчицкая Елена Львовна
- Театральные учебные заведения
- Электрическая постоянная