


БНБ
"БСЭ" (95279)
- Photogallery
- Естественные науки - Математика - Технология
- Авиация и машиностроение
- Высокие технологии
- Вычислительная техника
- Нанотехнология
- Роботехника
- Энергетика
- Электроника
Фосфор
Определение "Фосфор" в Большой Советской Энциклопедии
Фосфор (лат. Phosphorus), Р, химический элемент V группы периодической системы Менделеева, атомный номер 15, атомная масса 30,97376, неметалл. Природный Фосфор состоит из одного стабильного изотопа 31P; получено шесть искусственных радиоактивных изотопов: 28P (T1/2 = 6,27 сек), 29P (T1/2 = 4,45 сек); 30P (T1/2 = 2,55 мин), 31P (T1/2 = 14,22 сут), 32P (T1/2 = 25 сут), 33P (T1/2 = 12,5 сек). Наибольшее значение имеет 32P, обладающий значительной энергией b-излучения и применяемый в химических и биохимических исследованиях в качестве меченого атома.
Историческая справка. По некоторым литературным данным, способ получения Фосфор был известен ещё араб. алхимикам 12 в. Но общепринятой датой открытия Фосфор считается 1669, когда Х. Бранд (Германия) при прокаливании с песком сухого остатка от выпаривания мочи и последующей перегонкой без доступа воздуха получил светящееся в темноте вещество, названное сначала «холодным огнем», а позднее Фосфор от греч. phosphóros – светоносный. Вскоре способ получения Фосфор стал известен нем. химикам – И. Крафту, И. Кункелю; в 1682 об этом способе было опубликовано. В 1743 А. С. Маргграф разработал следующий способ получения Фосфор: смесь хлорида свинца с мочой выпаривалась досуха и нагревалась до прекращения выделения летучих продуктов; остаток смешивали с древесным углём в порошке и подвергали перегонке в глиняной реторте; пары Фосфор конденсировались в приёмнике с водой. Наиболее простой метод получения Фосфор прокаливанием костяной золы с углём был предложен лишь в 1771 К. Шееле. Элементарную природу Фосфор установил А. Лавуазье. Во 2-й половине 19 в. возникло промышленное производство Фосфор из фосфоритов в ретортных печах; в начале 20 в. они были заменены электрическими печами.
Распространение в природе. Среднее содержание Фосфор в земной коре (кларк) – 9,3×10-2% по массе; в средних горных породах 1,6×10-1, в основных породах 1,4×10-1, меньше в гранитах и др. кислых изверженных породах – 7×10-2 и ещё меньше в ультраосновных породах (мантии) – 1,7×10-2%; в осадочных горных породах от 1,7×10-2 (песчаники) до 4×10-2% (карбонатные породы). Фосфор принимает участие в магматических процессах и энергично мигрирует в биосфере. С обоими процессами связаны его крупные накопления, образующие промышленные месторождения апатитов и фосфоритов (см. Фосфатные руды). Фосфор – исключительно важный биогенный элемент, он накапливается многими организмами. С биогенной миграцией связаны многие процессы концентрации Фосфор в земной коре. Из вод Фосфор легко осаждается в виде нерастворимых минералов или захватывается живым веществом. Поэтому в морской воде лишь 7×10-6% Фосфор Известно около 180 минералов Фосфор, в основном – это различные фосфаты, из которых наиболее распространены фосфаты кальция (см. Фосфаты природные).
Физические свойства. Элементарный Фосфор существует в виде нескольких аллотропических модификаций, главная из которых – белая, красная и чёрная. Белый Фосфор – воскообразное, прозрачное вещество с характерным запахом, образуется при конденсации паров Фосфор Белый Фосфор в присутствии примесей – следов красного Фосфор, мышьяка, железа и т.п. – окрашен в жёлтый цвет, поэтому товарный белый Фосфор называется жёлтым. Существуют две формы белого Фосфор: a- и b-форма. a-модификация представляет собой кристаллы кубической системы (а = 18,5 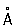 ); плотность 1,828 г/см3, tпл 44,1 °С, tкип 280,5 °C, теплота плавления 2,5 кдж/моль P4 (0,6 ккал/моль P4), теплота испарения 58,6 кдж/моль Р4(14,0 ккал/моль P4), давление пара при 25 °С 5,7 н/м2 (0,043 мм рт. ст.). Коэффициент линейного расширения в интервале температур от 0 до 44 °С равен 12,4×10-4, теплопроводность 0,56 вт/(м×К) [1,1346×10-3 кал/(см×сек×°С)] при 25 °С. По электрическим свойствам «белый Фосфор близок к диэлектрикам: ширина запрещенной зоны около 2,1 эв, удельное электросопротивление 1,54×1011 ом×см, диамагнитен, удельная магнитная восприимчивость – 0,86×10-6. Твёрдость по Бринеллю 6 Мн/м2 (0,6 кгс/мм2). a-форма белого Фосфор хорошо растворяется в сероуглероде, хуже – в жидком аммиаке, бензоле, четырёххлористом углероде и др. При – 76,9 °С и давлении 0,1 Мн/м2 (1 кгс/см2) a-форма переходит в низкотемпературную b-форму (плотность 1,88 г/см3). С повышением давления до 1200 Мн/м2 (12 тыс. кгс/см2) переход происходит при 64,5 °С. b-форма – кристаллы с двойным лучепреломлением, их структура окончательно не установлена. Белый Фосфор ядовит: на воздухе при температуре около 40 °С самовоспламеняется, поэтому его следует хранить под водой (растворимость в воде при 25 °С 3,3×10-4%). Нагреванием белого Фосфор без доступа воздуха при 250–300 °С в течение нескольких часов получают красный Фосфор Переход экзотермичен, ускоряется ультрафиолетовыми лучами, а также примесями (иод, натрий, селен). Обычный товарный красный Фосфор практически полностью аморфен; имеет цвет от тёмно-коричневого до фиолетового. При длительном нагревании, необратимо может переходить в одну из кристаллических форм (триклинную, кубическую и др.) с различными свойствами: плотностью от 2,0 до 2,4 г/см3, tпл от 585 до 610 °С при давлении в несколько десятков атмосфер, температурой возгонки от 416 до 423 °С, удельным электросопротивлением от 109 до 1014 ом×см. Красный Фосфор на воздухе не самовоспламеняется; вплоть до температуры 240–250 °С, но самовоспламеняется при трении или ударе; нерастворим в воде, а также в бензоле, сероуглероде и др., растворим в трибромиде Фосфор При температуре возгонки красный Фосфор превращается в пар, при охлаждении которого образуется в основном белый Фосфор
); плотность 1,828 г/см3, tпл 44,1 °С, tкип 280,5 °C, теплота плавления 2,5 кдж/моль P4 (0,6 ккал/моль P4), теплота испарения 58,6 кдж/моль Р4(14,0 ккал/моль P4), давление пара при 25 °С 5,7 н/м2 (0,043 мм рт. ст.). Коэффициент линейного расширения в интервале температур от 0 до 44 °С равен 12,4×10-4, теплопроводность 0,56 вт/(м×К) [1,1346×10-3 кал/(см×сек×°С)] при 25 °С. По электрическим свойствам «белый Фосфор близок к диэлектрикам: ширина запрещенной зоны около 2,1 эв, удельное электросопротивление 1,54×1011 ом×см, диамагнитен, удельная магнитная восприимчивость – 0,86×10-6. Твёрдость по Бринеллю 6 Мн/м2 (0,6 кгс/мм2). a-форма белого Фосфор хорошо растворяется в сероуглероде, хуже – в жидком аммиаке, бензоле, четырёххлористом углероде и др. При – 76,9 °С и давлении 0,1 Мн/м2 (1 кгс/см2) a-форма переходит в низкотемпературную b-форму (плотность 1,88 г/см3). С повышением давления до 1200 Мн/м2 (12 тыс. кгс/см2) переход происходит при 64,5 °С. b-форма – кристаллы с двойным лучепреломлением, их структура окончательно не установлена. Белый Фосфор ядовит: на воздухе при температуре около 40 °С самовоспламеняется, поэтому его следует хранить под водой (растворимость в воде при 25 °С 3,3×10-4%). Нагреванием белого Фосфор без доступа воздуха при 250–300 °С в течение нескольких часов получают красный Фосфор Переход экзотермичен, ускоряется ультрафиолетовыми лучами, а также примесями (иод, натрий, селен). Обычный товарный красный Фосфор практически полностью аморфен; имеет цвет от тёмно-коричневого до фиолетового. При длительном нагревании, необратимо может переходить в одну из кристаллических форм (триклинную, кубическую и др.) с различными свойствами: плотностью от 2,0 до 2,4 г/см3, tпл от 585 до 610 °С при давлении в несколько десятков атмосфер, температурой возгонки от 416 до 423 °С, удельным электросопротивлением от 109 до 1014 ом×см. Красный Фосфор на воздухе не самовоспламеняется; вплоть до температуры 240–250 °С, но самовоспламеняется при трении или ударе; нерастворим в воде, а также в бензоле, сероуглероде и др., растворим в трибромиде Фосфор При температуре возгонки красный Фосфор превращается в пар, при охлаждении которого образуется в основном белый Фосфор
При нагревании белого Фосфор до 200–220 °С под давлением (1,2–1,7)×103Мн/м2 [(12–17)×103 кгс/см2] образуется чёрный Фосфор Это превращение можно осуществить без давления, но в присутствии ртути и небольшого количества кристаллов чёрного Фосфор (затравки) при 370 °С в течение 8 сут. Чёрный Фосфор представляет собой кристаллы ромбической структуры (а = 3,31 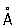 , b = 4,38
, b = 4,38 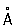 , с = 10,50
, с = 10,50 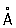 ), решётка построена из волокнистых слоев с характерным для Фосфор пирамидальным расположением атомов, плотность 2,69 г/см3, tпл около 1000 °С под давлением 1,8×103 Мн/м2 (18×103 кгс/см2). По внешнему виду чёрный Фосфор похож на графит; полупроводник: ширина запрещенной зоны 0,33 эв при 25 °С; имеет удельное электросопротивление 1,5 ом×см, температурный коэффициент электросопротивления 0,0077, диамагнитен, удельная магнитная восприимчивость – 0,27×10-6. При нагревании до 560–580 °С под давлением собственных паров превращается в красный Фосфор Чёрный Фосфор малоактивен, с трудом воспламеняется при поджигании, поэтому его можно безопасно подвергать механической обработке на воздухе.
), решётка построена из волокнистых слоев с характерным для Фосфор пирамидальным расположением атомов, плотность 2,69 г/см3, tпл около 1000 °С под давлением 1,8×103 Мн/м2 (18×103 кгс/см2). По внешнему виду чёрный Фосфор похож на графит; полупроводник: ширина запрещенной зоны 0,33 эв при 25 °С; имеет удельное электросопротивление 1,5 ом×см, температурный коэффициент электросопротивления 0,0077, диамагнитен, удельная магнитная восприимчивость – 0,27×10-6. При нагревании до 560–580 °С под давлением собственных паров превращается в красный Фосфор Чёрный Фосфор малоактивен, с трудом воспламеняется при поджигании, поэтому его можно безопасно подвергать механической обработке на воздухе.
Атомный радиус Фосфор 1,34 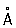 , ионные радиусы: P5 + 0,35
, ионные радиусы: P5 + 0,35 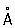 , P3 + 0,44
, P3 + 0,44 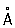 , P3- 1,86
, P3- 1,86 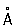 .
.
Атомы Фосфор объединяются в двухатомные (P2), четырёхатомные (P4) и полимерные молекулы. Наиболее стабильны при нормальных условиях полимерные молекулы, содержащие длинные цепи связанных между собой P4 – тетраэдров. В жидком, твёрдом виде (белый Фосфор) и в парах ниже 800 °С Фосфор состоит из молекул P4. При температурах выше 800 °С молекулы P4 диссоциируют на P2, которые, в свою очередь, распадаются на атомы при температуре свыше 2000 °С. Только белый Фосфор состоит из молекул P4, все остальные модификации – полимеры.
Химические свойства. Конфигурация внешних электронов атома Фосфор 3s23p3, в соединениях наиболее характерны степени окисления + 5, + 3, и – 3. Подобно азоту, Фосфор в соединениях главным образом ковалентен. Ионных соединений, подобных фосфидам Na3P, Ca3P2, очень мало. В отличие от азота, Фосфор обладает свободными 3d-opбиталями с довольно низкими энергиями, что приводит к возможности увеличения координационного числа и образованию донорно-акцепторных связей.
Фосфор химически активен, наибольшей активностью обладает белый Фосфор; красный и чёрный Фосфор в химических реакциях гораздо пассивнее. Окисление белого Фосфор происходит по механизму цепных реакций. Окисление Фосфор обычно сопровождается хемилюминесценцией. При горении Фосфор в избытке кислорода образуется пятиокись P4O10 (или P2O5), при недостатке – в основном трёхокись P4O6 (или P2O3). Спектроскопически доказано существование в парах P4O7, P4O8, P2O6, PO и др. фосфора окислов. Пятиокись Фосфор получают в промышленных масштабах сжиганием элементарного Фосфор в избытке сухого воздуха. Последующая гидратация P4O10 приводит к получению орто- (Н3РО4) и поли- (Нn + 2PnO3п + 1) фосфорных кислот. Кроме того, Фосфор образует фосфористую кислоту H3PO3, фосфорноватую кислоту H4P2O6 и фосфорноватистую кислоту H3PO2, а также надкислоты: надфосфорную H4P2O8 и мононадфосфорную H3PO5 Широкое применение находят соли фосфорных кислот (фосфаты), в меньшей степени – фосфиты и гипофосфиты.
Фосфор непосредственно соединяется со всеми галогенами с выделением большого количества тепла и образованием тригалогенидов (PX3, где Х – галоген), пентагалогенидов (PX5) и оксигалогенидов (например, POX3) (см. Фосфора галогениды). При сплавлении Фосфор с серой ниже 100 °С образуются твёрдые растворы на основе Фосфор и серы, а выше 100 °С происходит экзотермическая реакция образования кристаллических сульфидов P4S3, P4S5, P4S7, P4S10, из которых только P4S5 при нагревании выше 200 °С разлагается на P4S3 и P4S7, а остальные плавятся без разложения. Известны оксисульфиды фосфора: P2O3S2, P2O3S3, P4O4S3, P6O10S5 и P4O4S3. Фосфор по сравнению с азотом менее способен к образованию соединений с водородом. Фосфористый водород фосфин PH3 и дифосфин P2H4 могут быть получены только косвенным путём. Из соединений Фосфор с азотом известны нитриды PN, P2N3, P3N5 – твёрдые, химически устойчивые вещества, полученные при пропускании азота с парами Фосфор через электрическую дугу; полимерные фосфонитрилгалогениды – (PNX2) n (например, полифосфонитрилхлорид), полученные взаимодействием пентагалогенидов с аммиаком при различных условиях; амидоимидофосфаты – соединения, как правило, полимерные, содержащие наряду с Р–О–Р связями Р–NH–Р связи.
При температурах выше 2000°C Фосфор реагирует с углеродом с образованием карбида PC3 – вещества, не растворяющегося в обычных растворителях и не взаимодействующего ни с кислотами, ни со щелочами. При нагревании с металлами Фосфор образует фосфиды.
Фосфор образует многочисленные фосфорорганические соединения.
Получение. производство элементарного Фосфор осуществляется электротермическим восстановлением его из природных фосфатов (апатитов или фосфоритов) при 1400–1600 °С коксом в присутствии кремнезёма (кварцевого песка):
2Ca3(PO4)2 + 10C + nSiO2 = P4 + 10CO + 6CaO×nSiO2
Предварительно измельченная и обогащенная фосфорсодержащая руда смешивается в заданных соотношениях с кремнезёмом и коксом и загружается в электропечь. Кремнезём необходим для снижения температуры реакции, а также увеличения ее скорости за счет связывания выделяющейся в процессе восстановления окиси кальция в силикат кальция, который непрерывно удаляется в виде расплавленного шлака. В шлак переходят также силикаты и окислы алюминия, магния, железа и др. примеси, а также феррофосфор (Fe2P, FeP, Fe3P), образующийся при взаимодействии части восстановленного железа с Фосфор Феррофосфор, а также растворённые в нём небольшие количества фосфидов марганца и др. металлов по мере накопления удаляются из электропечи с целью последующего использования при производстве специальных сталей.
Пары Фосфор выходят из электропечи вместе с газообразными побочными продуктами и летучими примесями (CO, SiF4, PH3, пары воды, продукты пиролиза органических примесей шихты и др.) при температуре 250–350 °С. После очистки от пыли содержащие фосфор газы направляют в конденсационные установки, в которых при температуре не ниже 50 °С собирают под водой жидкий технический белый Фосфор
Разрабатываются методы получения Фосфор с применением газообразных восстановителей, плазменных реакторов с целью интенсификации производства за счёт повышения температур до 2500–3000 °С, т. е. выше температур диссоциации природных фосфатов и газов-восстановителей (например, метана), используемых в качестве транспортирующего газа в низкотемпературной плазме.
Применение. Основная масса производимого Фосфор перерабатывается в фосфорную кислоту и получаемые на её основе фосфорные удобрения и технические соли (фосфаты).
Белый Фосфор используется в зажигательных и дымовых снарядах, бомбах; красный Фосфор – в спичечном производстве. Фосфор применяется в производстве сплавов цветных металлов как раскислитель. Введение до 1% Фосфор увеличивает жаропрочность таких сплавов, как фехраль, хромаль. Фосфор входит в состав некоторых бронз, т.к. повышает их жидкотекучесть и стойкость против истирания. Фосфиды металлов, а также некоторых неметаллов (В, Si, As и т.п.) используются при получении и легировании полупроводниковых материалов. Частично Фосфор применяется для получения хлоридов и сульфидов, которые служат исходными веществами для производства фосфорсодержащих пластификаторов (например, трикрезилфосфат, трибутилфосфат и др.), медикаментов, фосфорорганических пестицидов, а также применяются в качестве добавок в смазочные вещества и в горючее.
Техника безопасности. Белый Фосфор и его соединения высокотоксичны. Работа с Фосфор требует тщательной герметизации аппаратуры; хранить белый Фосфор следует под водой или в герметически закрытой металлической таре. При работе с Фосфор следует строго соблюдать правила техники безопасности.
Л. В. Кубасова.
Фосфор в организме. Фосфор – один из важнейших биогенных элементов, необходимый для жизнедеятельности всех организмов. Присутствует в живых клетках в виде орто- и пирофосфорной кислот и их производных, а также входит в состав нуклеотидов, нуклеиновых кислот, фосфопротеидов, фосфолипидов, фосфорных эфиров углеводов, многих коферментов и др. органических соединений. Благодаря особенностям химического строения атомы Фосфор, подобно атомам серы, способны к образованию богатых энергией связей в макроэргических соединениях; аденозинтрифосфорной кислоте (АТФ), креатин фосфате и др. (см. Окислительное фосфорилирование). В процессе биологической эволюции именно фосфорные соединения стали основными, универсальными хранителями генетической информации и переносчиками энергии во всех живых системах. Др. важная роль соединений Фосфор в организме заключается в том, что ферментативное присоединение фосфорильного остатка (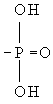 ) к различным органическим соединениям (фосфорилирование) служит как бы «пропуском» для их участия в обмене веществ, и, наоборот, отщепление фосфорильного остатка (дефосфорилирование) исключает эти соединения из активного обмена. Ферменты обмена Фосфор – киназы, фосфорилазы и фосфатазы. Главную роль в превращениях соединений Фосфор в организме животных и человека играет печень. Обмен фосфорных соединений регулируется гормонами и витамином D.
) к различным органическим соединениям (фосфорилирование) служит как бы «пропуском» для их участия в обмене веществ, и, наоборот, отщепление фосфорильного остатка (дефосфорилирование) исключает эти соединения из активного обмена. Ферменты обмена Фосфор – киназы, фосфорилазы и фосфатазы. Главную роль в превращениях соединений Фосфор в организме животных и человека играет печень. Обмен фосфорных соединений регулируется гормонами и витамином D.
Содержание Фосфор (в мг на 100 г сухого вещества) в тканях растений – 230–350, морских животных – 400–1800, наземных – 1700–4400, у бактерий – около 3000; в организме человека особенно много Фосфор в костной ткани (несколько более 5000), в тканях мозга (около 4000) и в мышцах (220–270). Суточная потребность человека в Фосфор 1–1,2 г (у детей она выше, чем у взрослых). Из продуктов питания наиболее богаты Фосфор сыр, мясо, яйца, зерно бобовых культур (горох, фасоль и др.). Баланс Фосфор в организме зависит от общего состояния обмена веществ. Нарушение фосфорного обмена приводит к глубоким биохимическим изменениям, в первую очередь в энергетическом обмене. При недостатке Фосфор в организме у животных и человека развиваются остеопороз и др. заболевания костей, у растений – фосфорное голодание (см. Диагностика питания растений). Источником Фосфор в живой природе служат его неорганические соединения, содержащиеся в почве и растворённые в воде. Из почвы Фосфор извлекается растениями в виде растворимых фосфатов. Животные обычно получают достаточное количество Фосфор с пищей. После гибели организмов Фосфор вновь поступает в почву и донные отложения, участвуя т. о. в круговороте веществ. Важная роль Фосфор в регуляции обменных процессов обусловливает высокую чувствительность многих ферментных систем живых клеток к действию фосфорорганических соединений. Это обстоятельство используют в медицине при разработке лечебных препаратов, в сельском хозяйстве при производстве фосфорных удобрений, а также при создании эффективных инсектицидов. Многие соединения Фосфор чрезвычайно токсичны и некоторые из фосфорорганических соединений могут быть причислены к боевым отравляющим веществам (зарин, зоман, табун). Радиоактивный изотоп Фосфор 32P широко используют в биологии и медицине как индикатор при исследовании всех видов обмена веществ и энергии в живых организмах (см. Изотопные индикаторы).
Н. Н. Чернов.
Отравления Фосфор и его соединениями наблюдаются при их термоэлектрической возгонке, работе с белым Фосфор, производстве и применении фосфорных соединений. Высокотоксичны фосфорорганические соединения, оказывающие антихолинэстеразное действие. Фосфор проникает в организм через органы дыхания, желудочно-кишечный тракт, кожу. Острые отравления проявляются жжением во рту и желудке, головной болью, слабостью, тошнотой, рвотой. Через 2–3 сут возникают боли в подложечной области, правом подреберье, желтуха. Для хронических отравлений характерны воспаление слизистых оболочек верхних дыхательных путей, признаки токсического гепатита, нарушение кальциевого обмена (развитие остеопороза, ломкость, иногда омертвение костной ткани, чаще – на нижней челюсти), поражение сердечно-сосудистой и нервной систем. Первая помощь при остром отравлении через рот (наиболее частом) – промывание желудка, слабительное, очистительные клизмы, внутривенно растворы глюкозы, хлористого кальция и др. При ожогах кожи – обработать пораженные участки растворами медного купороса или соды. Глаза промывают 2%-ным раствором питьевой соды. Профилактика: соблюдение правил техники безопасности, личная гигиена, уход за полостью рта, раз в 6 мес – медицинские осмотры работающих с Фосфор
Лекарственные препараты, содержащие Фосфор (аденозинтрифосфорная кислота, фитин, глицерофосфат кальция, фосфрен и др.), влияют главным образом на процессы тканевого обмена и применяются при заболеваниях мышц, нервной системы, при туберкулёзе, упадке питания, малокровии и др. Радиоактивные изотопы Фосфор используют в качестве изотопных индикаторов для изучения обмена веществ, диагностики заболеваний, а также для лучевой терапии опухолей (см. также Радиоактивные препараты).
А. А. Каспаров.
Лит.: Краткая химическая энциклопедия, т. 5, М., 1967; Коттон Фосфор, Уилкинсон Дж., Современная неорганическая химия, пер. с англ., ч. 2, М., 1969; Везер Ван-Дж.. Фосфор и его соединения, пер. с англ., т. 1, М., 1962; Ахметов Н. С., Неорганическая химия, 2 изд., М., 1975; Некрасов Б. В., Основы общей химии, 3 изд., т. 1–2, М., 1973; Моссэ А. Л., Печковский В. В., Применение низкотемпературной плазмы в технологии неорганических веществ, Минск, 1973; Горизонты биохимии, Сб. ст., пер. с англ., М., 1964; Рапопорт С. М., Медицинская биохимия, пер, с нем., М., 1966; Скулачев В. П., Аккумуляция энергии в клетке, М., 1969; Происхождение жизни и эволюционная биохимия, М., 1975.
| "БСЭ" >> "Ф" >> "ФО" >> "ФОС" |
Статья про "Фосфор" в Большой Советской Энциклопедии была прочитана 722 раз
| Коптим скумбрию в коробке |
| Куриный суп |
TOP 20
- Лемке Михаил Константинович
- Сульфгидрильные группы
- «Казарменный коммунизм»
- Японское море
- Периодическая система элементов
- Глициния
- Башкирская Автономная Советская Социалистическая Республика
- Иммунитет (историч.)
- Объединённая партия гаитянских коммунистов
- Андаманское море
- Сенсуализм
- «Сообразительный»
- Балкано-кавказская раса
- Навигация (морск.)
- Звёздная астрономия
- Ямполь (пос. гор. типа в Донецкой обл.)
- Мандельштама - Бриллюэна рассеяние
- Кульчицкая Елена Львовна
- Театральные учебные заведения
- Электрическая постоянная