


БНБ
"БСЭ" (95279)
- Photogallery
- Естественные науки - Математика - Технология
- Авиация и машиностроение
- Высокие технологии
- Вычислительная техника
- Нанотехнология
- Роботехника
- Энергетика
- Электроника
Актиноиды
Определение "Актиноиды" в Большой Советской Энциклопедии
Актиноиды, актиниды, семейство из 14 химических элементов с атомными номерами Z 90 — 103, расположенных в 7 периоде системы Менделеева за актинием Ac и относящихся, как и актиний, к III группе системы. К Актиноиды принадлежат: торий Th (Z=90), протактиний Pa(91), уран U (92), нептуний Np(93), плутоний Pu (94), америций Am (95), кюрий Cm(96), берклий Bk (97), калифорний Cf (98), эйнштейний Es (99), фермий Fm (100), менделевий Md (101), элемент № 102, не имеющий пока общепринятого названия, и лоуренсий Lr (103). Все Актиноиды радиоактивны, т. е. не имеют стабильных изотопов. Th, Pa и U принадлежат к естественно-радиоактивным элементам, встречающимся в природе, и открытым ранее др. Актиноиды Остальные Актиноиды, часто называемые трансурановыми элементами, получены в 1940—63 искусственным путём при помощи ядерных реакций. Из них только Np и Pu обнаружены в ничтожно малых количествах в некоторых радиоактивных рудах, более «тяжёлые» Актиноиды (т. е. Актиноиды с большими атомными номерами) в природе не найдены. Огромная заслуга в изучении Актиноиды принадлежит американскому химику Г. Т. Сиборгу, который выдвинул гипотезу о существовании группы Актиноиды (1942) и под руководством или при участии которого было впервые синтезировано девять Актиноиды Выделение Актиноиды в специальное семейство связано со схожестью химических свойств этих элементов между собой и с актинием, что объясняется сходным строением наружных электронных оболочек их атомов (см. ниже).
Название Актиноиды (от актиний и греч. éidos — вид) означает — подобные актинию. Оно дано Актиноиды по аналогии с лантаноидами — семейством из 14 элементов, также относящихся к III группе системы Менделеева и следующих в 6-м периоде за лантаном. Свойства элементов обоих семейств во многом сходны друг с другом.
Близость химических свойств Актиноиды между собой и их сходство с лантаноидами связаны с особенностями строения электронных оболочек атомов этих семейств. Как известно, атом состоит из ядра и электронных оболочек, число которых равно номеру периода элемента в таблице Менделеева (у Актиноиды электронных оболочек 7). Отличие Актиноиды (и соответственно лантаноидов) от др. элементов состоит в том, что при переходе от первого Актиноиды — Th (Z = 90) ко второму — Pa (Z = 91) и т. д. вплоть до последнего Актиноиды — Lr (Z = 103), каждый новый электрон, появляющийся в атомах параллельно с увеличением атомного номера (Z), попадает не на внешние оболочки (6-ю и 7-ю от ядра), как это бывает обычно, а заполняет более близкую к ядру 5-ю оболочку. У лантаноидов (число оболочек 6) также заполняется электронами более близкая к ядру 4-я оболочка (а не наружные — 5-я и 6-я). Таким образом, у элементов обоих семейств происходит заполнение 3-й снаружи электронной оболочки, а строение 2 наружных оболочек оказывается сходным. Число электронов на этих наружных оболочках у Актиноиды и лантаноидов, как правило, не отличается более чем на 1, причём почти во всех случаях представители каждого из семейств, равноудалённые соответственно от лантана и актиния, содержат на 2 наружных оболочках строго одинаковое число электронов. (Здесь изложен лишь принцип заполнения электронных оболочек у атомов обоих семейств; во многих случаях, особенно у Актиноиды, порядок заполнения сложнее. См. Атом и Периодическая система элементов Д. И. Менделеева). Электронные конфигурации атомов Актиноиды даны в таблице.

То обстоятельство, что при переходе от Th к Lr число электронов на 2 внешних оболочках, как правило, не изменяется, а положительный заряд ядра постепенно возрастает, вызывает более сильное притяжение внешних электронов к ядру и приводит к т. н. актиноидному сжатию: у нейтральных атомов и ионов Актиноиды одинаковой валентности при увеличении атомного номера радиусы не увеличиваются, как это обычно бывает, а даже несколько уменьшаются (например, радиус U3+ равен 1,03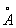 , Np3+ — 1,01
, Np3+ — 1,01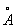 , Pu3+ — 1,00
, Pu3+ — 1,00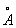 , Am3+ — 0,99
, Am3+ — 0,99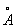 и т. д.).
и т. д.).
Химические свойства элемента зависят в основном от числа электронов на наружных слоях и размера атомных и ионных радиусов, поэтому не удивительно, что во-первых, свойства Актиноиды близки между собой, и, во-вторых, химическое поведение Актиноиды и лантаноидов обладает большим сходством. Это сходство особенно заметно тогда, когда элементы находятся в одинаковом валентном состоянии. Так, 3-валентные Актиноиды образуют те же нерастворимые соединения (гидроокиси, фториды, карбонаты, оксалаты и др.), что и 3-валентные лантаноиды; трифториды, трихлориды и другие аналогичные соединения 3-валентных Актиноиды образуют изоструктурные ряды [другими словами, соединения, входящие в такие ряды, например в ряд MeCl3, где Me — атом Актиноиды, обладают сходными кристаллическими решётками, параметры которых постепенно уменьшаются по мере роста атомного номера (Z) атома Актиноиды]. Такие же изоструктурные ряды образуют двуокиси, тетрафториды, гексафториды и другие соединения Актиноиды По склонности к гидролизу соединения 5-валентных Актиноиды, например пентахлориды, очень близки между собой. В растворах 6-валентные Актиноиды существуют в виде МеО22+-ионов и т. д. Приведённые примеры далеко не исчерпывают всех случаев сходства Актиноиды, пои на них можно убедиться в его наличии.
Однако, кроме общих черт, между Актиноиды и лантаноидами имеется и существенная разница. Так, Актиноиды часто образуют соединения в состояниях окисления, значительно более высоких, чем +3, что не характерно для лантаноидов. В своих соединениях Актиноиды проявляют следующие валентности (наиболее типичная выделена жирным шрифтом): Th (3, 4), Pa (3, 4,5), U (3, 4, 5, 6), Np (3, 4, 5, 6, 7), Pu (3,4,5, 6, 7), Am (3, 4, 5, 6), Cm (3, 4), Bk (3,4), Cf (2, 3), Es (3), Fm (3), Md (2, 3), № 102 (2, 3). Таким образом, валентность 3 характерна для Актиноиды только после Am. Первые члены семейства Актиноиды (Th, Pa и U) в своих соединениях чаще бывают соответственно 4-, 5- и 6-валентными. Актиноиды в большей степени, чем лантаноиды, склонны к комплексообразованию. Указанные особенности Актиноиды объясняются тем, что «вновь пришедшие» на 5-ю от ядра оболочку электроны (т. н. 5f-электроны или электроны 5f-подуровня) по энергии связи с ядром очень близки к электронам 6-й оболочки (т. н. 6d-электронам или электронам 6d-подуровня); эти 6d-электроны и могут проявлять себя как дополнительные валентные (см. табл.). У лантаноидов же «вновь пришедшие» 4f-электроны всегда связаны с ядром значительно прочнее, чем 5d-электроны. Близость энергии связи с ядром 5f- и 6d-электронов у Th, Pa и U приводит к тому, что f-электроны 5-й оболочки также могут проявлять себя как валентные. Валентность 3 оказывается для этих элементов не характерной, и по многим своим признакам они похожи на элементы не III, а, соответственно, IV, V и VI групп периодической системы (и долгое время в эти группы и помещались). В 1930-х и в начале 1940-х гг. считалось, что и следующие за U элементы Np и Pu также должны относиться соответственно к VII и VIII группам периодической системы, или, вследствие обнаруженных у Np и Pu черт сходства с U, их следует разместить вместе с U в VI группе. Однако анализ закономерностей изменения химических свойств элементов 7-го периода, особенно после открытия следующих за Pu Актиноиды, а также найденное экспериментально сходство кристаллографических, спектроскопических и магнитных характеристик соединений элементов, следующих за актинием, с соответствующими характеристиками лантаноидов, навели Сиборга на мысль, что трансурановые элементы должны рассматриваться как аналоги актиния, в результате чего и была выдвинута гипотеза о существовании семейства Актиноиды Актиноидная гипотеза в значительной мере способствовала успехам открытия Am, Cm и последующих Актиноиды, т. к. из неё следовало, что наиболее характерная валентность этих элементов должна быть равна 3, а не 4 и 6, как первоначально предполагали, и, следовательно, в этом валентном состоянии их и надо искать.
Электронные конфигурации атомов актиноидов<
| Элемент< | Число электронов на некоторых подуровнях | |||||||
| 5-й оболочки | 6-й оболочки | 7-й оболочки | ||||||
| s | p | d | f | s | p | d | s | |
| Th | 2 | 6 | 10 | 0 | 2 | 6 | 2 | 2 |
| Pa | 2 | 6 | 10 | 2 | 2 | 6 | 1 | 2 |
| U | 2 | 6 | 10 | 3 | 2 | 6 | 1 | 2 |
| Np | 2 | 6 | 10 | 4 | 2 | 6 | 1 | 2 |
| Pu | 2 | 6 | 10 | 6 | 2 | 6 | 0 | 2 |
| Am | 2 | 6 | 10 | 7 | 2 | 6 | 0 | 2 |
| Cm | 2 | 6 | 10 | 7 | 2 | 6 | 1 | 2 |
| Bk | 2 | 6 | 10 | 8 | 2 | 6 | 1 | 2 |
| Cf | 2 | 6 | 10 | 9 | 2 | 6 | 1 | 2 |
| Es | 2 | 6 | 10 | 11 | 2 | 6 | 0 | 2 |
| Fm | 2 | 6 | 10 | 12 | 2 | 6 | 0 | 2 |
| Md | 2 | 6 | 10 | 13 | 2 | 6 | 0 | 2 |
| 102 | 2 | 6 | 10 | 14 | 2 | 6 | 0 | 2 |
| Lr | 2 | 6 | 10 | 14 | 2 | 6 | 1 | 2 |
Свойства элементов, отнесённых Сиборгом к числу Актиноиды, по рассмотренным выше причинам, значительно сильнее различаются между собой, чем свойства лантаноидов, и поэтому вопрос о том, существует ли в действительности в 7-м периоде семейство Актиноиды (аналогичное семейству лантаноидов 6-го периода), или строение 7-го периода в этой его части более сложное, долгое время не был решен до конца. Решающее значение для окончательного вывода о строении 7-го периода имело изучение химических свойств 104-го элемента — курчатовия (открытого Г. Н. Флёровым с сотрудниками в 1964), проведённое в 1966 под руководством чешского химика И. Звары в Дубне (СССР). Оказалось, что по своим свойствам курчатовий резко отличается от предшествующих элементов и представляет собой аналог гафния, принадлежащего уже к IV группе периодической системы. Теоретические же расчёты показывают, что число элементов, у которых заполняется f-подуровень 3-й снаружи электронной оболочки, должно быть равно 14, и поэтому следует принять, что семейство 14 Актиноиды начинается с Th и завершается у Lr. В настоящее время все Актиноиды, как и лантаноиды, принято размещать в отдельном ряду внизу периодической системы.
Из-за близости химических свойств Актиноиды, особенно трансурановых, отделить их друг от друга крайне сложно. Для разделения Актиноиды очень полезным оказался метод ионообменной хроматографии, которым широко пользуются и для разделения лантаноидов. Поскольку этот метод сыграл важную роль в открытии и изучении Актиноиды и, кроме того, даёт ясное представление о работе с этими элементами, с ним стоит познакомиться подробнее. Стеклянную трубку, расположенную вертикально, заполняют специальным органическим полимером или смолой, а затем на этот полимер подают раствор, содержащий, например, 3-валентные ионы Актиноиды Ионы реагируют с полимером и оказываются связанными с ним химически. Для извлечения Актиноиды из трубки колонки через неё пропускают раствор, который содержит вещества, способные образовывать с ионами Актиноиды более прочные связи, чем органический полимер. Порядок выхода Актиноиды из колонки зависит, в основном, от ионного радиуса элементов, причём можно подобрать такие условия, что быстрее всего колонку покинут ионы с наименьшими радиусами. Т. к. радиусы ионов от Th к Lr постепенно уменьшаются, то выход ионов Актиноиды будет происходить в последовательности, обратной их атомным номерам Z. Порядок в выходе Актиноиды выполняется столь строго, что даёт возможность по наличию радиоактивных атомов в той или иной порции раствора, прошедшего через колонку, сделать вывод, какие именно элементы присутствуют в смеси, и точно определить их порядковые номера. Метод обладает высокой избирательностью, требует небольших затрат времени и пригоден даже тогда, когда в наличии имеется лишь несколько атомов элемента. Он был использован, в частности, при открытии Bk, Cf, Es, Fm и Md.
Из всех Актиноиды к настоящему времени практическое. применение находят главным образом Th, U и Р . Изотопы 233U, 235U и 239Pu служат как ядерное горючее в атомных реакторах и играют роль взрывчатого вещества в атомных бомбах. Некоторые изотопы Актиноиды (238Pu, 242Cm и др.), испускающие a-частицы высокой энергии, могут служить для создания источников тока со сроком службы до 10 лет и более, необходимых, например, для питания навигационной радиоаппаратуры спутников. В таких источниках тока тепловая энергия, выделяющаяся при радиоактивном распаде, при помощи специальных устройств преобразуется в электрический ток. Изучение свойств Актиноиды имеет большое теоретическое значение, т. к. позволяет расширить знания о свойствах атомных ядер, химическом поведении элементов и т. д.
Лит.: Хайд И., Сиборг Г. Т., Трансурановые элементы, пер. с англ., М., 1959; Сиборг Г., Кац Дж., Химия актинидных элементов, пер. с англ., М., 1960; Гольданский В. И., Новые элементы в Периодической системе Д. И. Менделеева, 3 изд., М., 1964; Лапицкий Актиноиды В., Цисурановые и трансурановые элементы, в сборнике: Рассказывают ученые-химики, М., 1964; Сиборг Г., Искусственные трансурановые элементы, пер. с англ., М., 1965; Хайд Э., Перлман И., Сиборг Г., Ядерные свойства тяжелых элементов, в. 1, Трансурановые элементы, пер. с англ., М., 1967.
С. С. Бердоносов.
| "БСЭ" >> "А" >> "АК" >> "АКТ" |
Статья про "Актиноиды" в Большой Советской Энциклопедии была прочитана 1510 раз
| Коптим скумбрию в коробке |
| Кукурузный крем суп со скатом |
TOP 20
- Лемке Михаил Константинович
- Сульфгидрильные группы
- «Казарменный коммунизм»
- Японское море
- Периодическая система элементов
- Глициния
- Башкирская Автономная Советская Социалистическая Республика
- Объединённая партия гаитянских коммунистов
- Иммунитет (историч.)
- Андаманское море
- Сенсуализм
- «Сообразительный»
- Балкано-кавказская раса
- Навигация (морск.)
- Звёздная астрономия
- Ямполь (пос. гор. типа в Донецкой обл.)
- Мандельштама - Бриллюэна рассеяние
- Кульчицкая Елена Львовна
- Театральные учебные заведения
- Электрическая постоянная