


БНБ
"БСЭ" (95279)
- Photogallery
- Естественные науки - Математика - Технология
- Авиация и машиностроение
- Высокие технологии
- Вычислительная техника
- Нанотехнология
- Роботехника
- Энергетика
- Электроника
Атомная физика
Определение "Атомная физика" в Большой Советской Энциклопедии
 |
| Зависимость тока от напряжения |
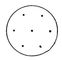 |
| Модель атома Томсона |
 |
| Периодическая зависимость атомного объёма от атомного номера |
 |
| Периодические зависимости от атомного номера |
 |
| Следы альфа-частиц в кислороде |
Периодическая система доказала существование связи между различными видами атомов. Напрашивался вывод, что атом имеет сложное строение, изменяющееся с атомной массой. Проблема раскрытия структуры атома стала важнейшей в химии и в физике (подробнее см. Атомизм).
Возникновение атомной физики. Важнейшими событиями в науке, от которых берёт начало Атомная физика, были открытия электрона и радиоактивности. При исследовании прохождения электрического тока через сильно разреженные газы были открыты лучи, испускаемые катодом разрядной трубки (катодные лучи) и обладающие свойством отклоняться в поперечном электрическом и магнитном полях. Выяснилось, что эти лучи состоят из быстро летящих отрицательно заряженных частиц, названных электронами. В 1897 английский физик Дж. Дж. Томсон измерил отношение заряда е этих частиц к их массе m. Было также обнаружено, что металлы при сильном нагревании или освещении светом короткой длины волны испускают электроны (см. Термоэлектронная эмиссия, фотоэлектронная эмиссия). Из этого было сделано заключение, что электроны входят в состав любых атомов. Отсюда далее следовало, что нейтральные атомы должны также содержать и положительно заряженные частицы. Положительно заряженные атомы — ионы — были действительно обнаружены при исследовании электрических разрядов в разреженных газах. Представление об атоме как о системе заряженных частиц объясняло, согласно теории голландского физика Х. Лоренца, саму возможность излучения атомом света (электромагнитных волн): электромагнитное излучение возникает при колебаниях внутриатомных зарядов; это получило подтверждение при исследовании действия магнитного поля на атомные спектры (см. Зеемана явление). Выяснилось, что отношение заряда внутриатомных электронов к их массе е/m, найденное Лоренцом в его теории явления Зеемана, в точности равно значению е/m для свободных электронов, полученному в опытах Томсона. Теория электронов и её экспериментальное подтверждение дали бесспорное доказательство сложности атома.
Представление о неделимости и непревращаемости атома было окончательно опровергнуто работами французских учёных М. Склодовской-Кюри и П. Кюри. В результате изучения радиоактивности было установлено (Ф. Содди), что атомы испытывают превращения двух типов. Испустив a-частицу (ион гелия с положительным зарядом 2e), атом радиоактивного химического элемента превращается в атом другого элемента, расположенного в периодической системе на 2 клетки левее, например атом полония — в атом свинца. Испустив b-частицу (электрон) с отрицательным зарядом -е, атом радиоактивного химического элемента превращается в атом элемента, расположенного на 1 клетку правее, например атом висмута — в атом полония. Масса атома, образовавшегося в результате таких превращений, оказывалась иногда отличной от атомного веса того элемента, в клетку которого он попадал. Отсюда следовало существование разновидностей атомов одного и того же химического элемента с различными массами; эти разновидности в дальнейшем получили название изотопов (т. е. занимающих одно и то же место в таблице Менделеева). Итак, представления об абсолютной тождественности всех атомов данного химического элемента оказались неверными.
Результаты исследования свойств электрона и радиоактивности позволили строить конкретные модели атома. В модели, предложенной Томсоном в 1903, атом представлялся в виде положительно заряженной сферы, в которую вкраплены незначительные по размеру (по сравнению с атомом) отрицательные электроны (рис. 3).
Они удерживаются в атоме благодаря тому, что силы притяжения их распределённым положительным зарядом уравновешиваются силами их взаимного отталкивания. Томсоновская модель давала известное объяснение возможности испускания, рассеяния и поглощения света атомом. При смещении электронов из положения равновесия возникает «упругая» сила, стремящаяся восстановить равновесие; эта сила пропорциональна смещению электрона из равновесного положения и, следовательно, дипольному моменту атома. Под действием электрических сил падающей электромагнитной волны электроны в атоме колеблются с той же частотой, что и электрическая напряжённость в световой волне; колеблющиеся электроны, в свою очередь, испускают свет той же частоты. Так происходит рассеяние электромагнитных волн атомами вещества. По степени ослабления светового пучка в толще вещества можно узнать общее число рассеивающих электронов, а зная число атомов в единице объёма, можно определить число электронов в каждом атоме.
Создание Резерфордом планетарной модели атома. Модель атома Томсона оказалась неудовлетворительной. На её основе не удалось объяснить совершенно неожиданный результат опытов английского физика Э. Резерфорда и его сотрудников Х. Гейгера и Э. Марсдена по рассеянию a-частиц атомами. В этих опытах быстрые a-частицы были применены для прямого зондирования атомов. Проходя через вещество, a-частицы сталкиваются с атомами. При каждом столкновении a-частица, пролетая через электрическое поле атома, изменяет направление движения — испытывает рассеяние. В подавляющем большинстве актов рассеяния отклонения a-частиц (углы рассеяния) были очень малы. Поэтому при прохождении пучка a-частиц через тонкий слой вещества происходило лишь небольшое размытие пучка. Однако очень малая доля a-частиц отклонялась на углы более 90°. Этот результат нельзя было объяснить на основе модели Томсона, т.к. электрическое поле в «сплошном» атоме недостаточно сильно, чтобы отклонить быструю и массивную a-частицу на большой угол. Чтобы объяснить результаты опытов по рассеянию a-частиц, Резерфорд предложил принципиально новую модель атома, напоминающую по строению Солнечную систему и получившую название планетарной. Она имеет следующий вид. В центре атома находится положительно заряженное ядро, размеры которого (~10-12см) очень малы по сравнению с размерами атома (~10-8 см), а масса почти равна массе атома. Вокруг ядра движутся электроны, подобно планетам вокруг Солнца; число электронов в незаряженном (нейтральном) атоме таково, что их суммарный отрицательный заряд компенсирует (нейтрализует) положительный заряд ядра. Электроны должны двигаться вокруг ядра, в противном случае они упали бы на него под действием сил притяжения. Различие между атомом и планетной системой состоит в том, что в последней действуют силы тяготения, а в атоме — электрические (кулоновские) силы. Вблизи ядра, которое можно рассматривать как точечный положительный заряд, существует очень сильное электрическое поле. Поэтому, пролетая вблизи ядра, положительно заряженные a-частицы (ядра гелия) испытывают сильное отклонение (см. рис. 4). В дальнейшем было выяснено (Г. Мозли), что заряд ядра возрастает от одного химического элемента к другому на элементарную единицу заряда, равную заряду электрона (но с положительным знаком). Численно заряд ядра атома, выраженный в единицах элементарного заряда е, равен порядковому номеру соответствующего элемента в периодической системе.
Для проверки планетарной модели Резерфорд и его сотрудник Ч. Дарвин подсчитали угловое распределение a-частиц, рассеянных точечным ядром — центром кулоновских сил. Полученный результат был проверен опытным путём — измерением числа a-частиц, рассеянных под разными углами. Результаты опыта в точности совпали с теоретическими расчётами, блестяще подтвердив тем самым планетарную модель атома Резерфорда.
Однако планетарная модель атома натолкнулась на принципиальные трудности. Согласно классической электродинамике, заряженная частица, движущаяся с ускорением, непрерывно излучает электромагнитную энергию. Поэтому электроны, двигаясь вокруг ядра, т. е. ускоренно, должны были бы непрерывно терять энергию на излучение. Но при этом они за ничтожную долю секунды потеряли бы всю свою кинетическую энергию и упали бы на ядро. Другая трудность, связанная также с излучением, состояла в следующем: если принять (в соответствии с классической электродинамикой), что частота излучаемого электроном света равна частоте колебаний электрона в атоме (т. е. числу оборотов, совершаемых им по своей орбите в одну секунду) или имеет кратное ей значение, то излучаемый свет по мере приближения электрона к ядру должен был бы непрерывно изменять свою частоту, и спектр излучаемого им света должен быть сплошным. Но это противоречит опыту. Атом излучает световые волны вполне определённых частот, типичных для данного химического элемента, и характеризуется спектром, состоящим из отдельных спектральных линий — линейчатым спектром. В линейчатых спектрах элементов был экспериментально установлен ряд закономерностей, первая из которых была открыта швейцарским учёным И. Бальмером (1885) в спектре водорода. Наиболее общая закономерность — комбинационный принцип — была найдена австрийским учёным В. Ритцем (1908). Этот принцип можно сформулировать следующим образом: для атомов каждого элемента можно найти последовательность чисел T1, T2, T3,... — т. н. спектральных термов, таких, что частота v каждой спектральной линии данного элемента выражается в виде разности двух термов: v = Tk - Ti. Для атома водорода терм Tn = R/n2, где n — целое число, принимающее значение n = 1, 2, 3,..., a R — т. н. постоянная Ридберга (см. Ридберга постоянная).
Т. о., в рамках модели атома Резерфорда не могли быть объяснены устойчивость атома по отношению к излучению и линейчатые спектры его излучения. На её основе не могли быть объяснены и законы теплового излучения, и законы фотоэлектрических явлений, которые возникают при взаимодействии излучения с веществом. Эти законы оказалось возможным объяснить, исходя из совершенно новых — квантовых— представлений, впервые введённых немецким физиком М. Планком (1900). Для вывода закона распределения энергии в спектре теплового излучения — излучения нагретых тел — Планк предположил, что атомы вещества испускают электромагнитную энергию (свет) в виде отдельных порций — квантов света, энергия которых пропорциональна v (частоте излучения): E = hv, где h — постоянная, характерная для квантовой теории и получившая название Планка постоянной. В 1905 А. Эйнштейн дал квантовое объяснение фотоэлектрических явлений, согласно которому энергия кванта hv идёт на вырывание электрона из металла —работа выхода Р — и на сообщение ему кинетическую энергии Ткин; hv = Р + Tкин. При этом Эйнштейн ввёл понятие о квантах света как особого рода частицах; эти частицы впоследствии получили название фотонов.
Противоречия модели Резерфорда оказалось возможным разрешить, лишь отказавшись от ряда привычных представлений классической физики. Важнейший шаг в построении теории атома был сделан датским физиком Н. Бором (1913).
Постулаты Бора и модель атома Бора. В основу квантовой теории атома Бор положил 2 постулата, характеризующих те свойства атома, которые не укладывались в рамки классической физики. Эти постулаты Бора могут быть сформулированы следующим образом:
1. Существование стационарных состояний. Атом не излучает и является устойчивым лишь в некоторых стационарных (неизменных во времени) состояниях, соответствующих дискретному (прерывному) ряду «дозволенных» значений энергии E1, E2, E3, E4,... Любое изменение энергии связано с квантовым (скачкообразным) переходом из одного стационарного состояния в другое.
2. Условие частот излучения (квантовых переходов с излучением). При переходе из одного стационарного состояния с энергией Ei в другое с энергией Ek атом испускает или поглощает свет определённой частоты v в виде кванта излучения (фотона) hv, согласно соотношению hv = Ei - Ek. При испускании атом переходит из состояния с большей энергией Ei в состояние с меньшей энергией Ek, при поглощении, наоборот, из состояния с меньшей энергией Ek в состояние с большей энергией Ei.
Постулаты Бора сразу позволяют понять физический смысл комбинационного принципа Ритца (см. выше); сравнение соотношений hv = Ei - Ek и v = Tk - Ti показывает, что спектральные термы соответствуют стационарным состояниям, и энергия последних должна равняться (с точностью до постоянного слагаемого) Ei = - hTi, Ek =- hTk.
При испускании или поглощении света изменяется энергия атома, это изменение равно энергии испущенного или поглощённого фотона, т. е. имеет место закон сохранения энергии. Линейчатый спектр атома является результатом дискретности возможных значений его энергии.
Для определения дозволенных значений энергии атома — квантования его энергии — и для нахождения характеристик соответствующих стационарных состояний Бор применил классическую (ньютоновскую) механику. «Если мы желаем вообще составить наглядное представление о стационарных состояниях, у нас нет других средств, по крайней мере сейчас, кроме обычной механики», — писал Бор в 1913 («Три статьи о спектрах и строении атомов», М.—Л., 1923, с. 22). Для простейшего атома — атома водорода, состоящего из ядра с зарядом +е (протона) и электрона с зарядом -e, Бор рассмотрел движение электрона вокруг ядра по круговым орбитам. Сравнивая энергию атома Е со спектральными термами Tn = R/n2 для атома водорода, найденными с большой точностью из частот его спектральных линий, он получил возможные значения энергии атома En = -hTn = -hR/n2(где n = 1, 2, 3,...). Они соответствуют круговым орбитам радиуса аn = а0n2, где a0 = 0,53·10-8 см — боровский радиус — радиус наименьшей круговой орбиты (при n = 1). Бор вычислил частоты обращения v электрона вокруг ядра по круговым орбитам в зависимости от энергии электрона. Оказалось, что частоты излучаемого атомом света не совпадают с частотами обращения vn, как этого требует классическая электродинамика, а пропорциональны, согласно соотношению hv = Ei - Ek, разности энергий электрона на двух возможных орбитах.
Для нахождения связи частоты обращения электрона по орбите и частоты излучения Бор сделал предположение, что результаты квантовой и классической теорий должны совпадать при малых частотах излучения (для больших длин волн; такое совпадение имеет место для теплового излучения, законы которого были выведены Планком). Он приравнял для больших n частоту перехода v = (En+1 - En)/h частоте обращения vn по орбите с данным n и вычислил значение постоянной Ридберга R, которое с большой точностью совпало со значением R, найденным из опыта, что подтвердило боровское предположение. Бору удалось также не только объяснить спектр водорода, но и убедительно показать, что некоторые спектральные линии, которые приписывались водороду, принадлежат гелию. Предположение Бора о том, что результаты квантовой и классической теорий должны совпадать в предельном случае малых частот излучения, представляло первоначальную форму т. н. принципа соответствия. В дальнейшем Бор успешно применил его для нахождения интенсивностей линий спектра. Как показало развитие современной физики, принцип соответствия оказался весьма общим (см. Соответствия принцип).
В теории атома Бора квантование энергии, т. е. нахождение её возможных значений, оказалось частным случаем общего метода нахождения «дозволенных» орбит. Согласно квантовой теории, такими орбитами являются только те, для которых момент количества движения электрона в атоме равен целому кратному h/2p. Каждой дозволенной орбите соответствует определённое возможное значение энергии атома (см. Атом).
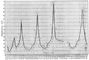
Основные положения квантовой теории атома — 2 постулата Бора — были всесторонне подтверждены экспериментально. Особенно наглядное подтверждение дали опыты немецких физиков Дж. Франка и Г. Герца (1913—16). Суть этих опытов такова. Поток электронов, энергией которых можно управлять, попадает в сосуд, содержащий пары ртути. Электронам сообщается энергия, которая постепенно повышается. По мере увеличения энергии электронов ток в гальванометре, включенном в электрическую цепь, увеличивается; когда же энергия электронов оказывается равной определённым значениям (4,9; 6,7; 10,4 эв), ток резко падает (рис. 5). Одновременно можно обнаружить, что пары ртути испускают ультрафиолетовые лучи определённой частоты.
Изложенные факты допускают только одно истолкование. Пока энергия электронов меньше 4,9 эв, электроны при столкновении с атомами ртути не теряют энергии — столкновения имеют упругий характер. Когда же энергия оказывается равной определённому значению, именно 4,9 эв, электроны передают свою энергию атомам ртути, которые затем испускают её в виде квантов ультрафиолетового света. Расчёт показывает, что энергия этих фотонов равна как раз той энергии, которую теряют электроны. Эти опыты доказали, что внутренняя энергия атома может иметь только определённые дискретные значения, что атом поглощает энергию извне и испускает её сразу целыми квантами и что, наконец, частота испускаемого атомом света соответствует теряемой атомом энергии.
Дальнейшее развитие Атомная физика показало справедливость постулатов Бора не только для атомов, но и для других микроскопических систем — для молекул и для атомных ядер. Эти постулаты следует рассматривать как твёрдо установленные опытные квантовые законы. Они составляют ту часть теории Бора, которая не только сохранилась при дальнейшем развитии квантовой теории, но и получила своё обоснование. Иначе обстоит дело с моделью атома Бора, основанной на рассмотрении движения электронов в атоме по законам классической механики при наложении дополнительных условий квантования. Такой подход позволил получить целый ряд важных результатов, но был непоследовательным: квантовые постулаты были присоединены к законам классической механики искусственно. Последовательной теорией явилась созданная в 20-х гг. 20 в. квантовая механика. Её создание было подготовлено дальнейшим развитием модельных представлений теории Бора, в ходе которого выяснились её сильные и слабые стороны.
Развитие модельной теории атома Бора. Весьма важным результатом теории Бора было объяснение спектра атома водорода. Дальнейший шаг в развитии теории атомных спектров был сделан немецким физиком А. Зоммерфельдом. Разработав более детально правила квантования, исходя из более сложной картины движения электронов в атоме (по эллиптическим орбитам) и учитывая экранирование внешнего (т. н. валентного) электрона в поле ядра и внутренних электронов, он сумел дать объяснение ряда закономерностей спектров щелочных металлов.
Теория атома Бора пролила свет и на структуру т. н. характеристических спектров рентгеновского излучения. Рентгеновские спектры атомов так же, как и их оптические спектры, имеют дискретную линейчатую структуру, характерную для данного элемента (отсюда и название). Исследуя характеристические рентгеновские спектры различных элементов, английский физик Г. Мозли открыл следующую закономерность: квадратные корни из частот испускаемых линий равномерно возрастают от элемента к элементу по всей периодической системе Менделеева пропорционально атомному номеру элемента. Интересно то обстоятельство, что закон Мозли полностью подтвердил правоту Менделеева, нарушившего в некоторых случаях принцип размещения элементов в таблице по возрастающему атомному весу и поставившего некоторые более тяжёлые элементы впереди более лёгких.
На основе теории Бора удалось дать объяснение и периодичности свойств атомов. В сложном атоме образуются электронные оболочки, которые последовательно заполняются, начиная от самой внутренней, определёнными числами электронов (физическая причина образования оболочек стала ясна только на основании принципа Паули, см. ниже). Структура внешних электронных оболочек периодически повторяется, что обусловливает периодическая повторяемость химических и многих физических свойств элементов, расположенных в одной и той же группе периодической системы. На основе же теории Бора немецким химиком В. Косселем были объяснены (1916) химического взаимодействия в т. н. гетерополярных молекулах.
Однако далеко не все вопросы теории атома удалось объяснить на основе модельных представлений теории Бора. Она не справлялась со многими задачами теории спектров, позволяла получать лишь правильные значения частот спектральных линий атома водорода и водородоподобных атомов, интенсивности же этих линий оставались необъяснёнными; Бору для объяснения интенсивностей пришлось применить принцип соответствия.
При переходе к объяснению движений электронов в атомах, более сложных, чем атом водорода, модельная теория Бора оказалась в тупике. Уже атом гелия, в котором вокруг ядра движутся 2 электрона, не поддавался теоретической интерпретации на её основе. Трудности при этом не исчерпывались количественными расхождениями с опытом. Теория оказалась бессильной и в решении такой проблемы, как соединение атомов в молекулу. Почему 2 нейтральных атома водорода соединяются в молекулу водорода? Как вообще объяснить природу валентности? Что связывает атомы твёрдого тела? Эти вопросы оставались без ответа. В рамках боровской модели нельзя было найти подхода к их решению.
Квантовомеханическая теория атома. Ограниченность боровской модели атома коренилась в ограниченности классических представлений о движении микрочастиц. Стало ясно, что для дальнейшего развития теории атома необходимо критически пересмотреть основные представления о движении и взаимодействии микрочастиц. Неудовлетворительность модели, основанной на классической механике с добавлением условий квантования, отчётливо понимал и сам Бор, взгляды которого оказали большое влияние на дальнейшее развитие Атомная физика Началом нового этапа развития Атомная физика послужила идея, высказанная французским физиком Л. де Бройлем (1924) о двойственной природе движения микрообъектов, в частности электрона (см. Волны де Бройля). Эта идея стала исходным пунктом квантовой механики, созданной в 1925—26 трудами В. Гейзенберга и М. Борна (Германия), Э. Шрёдингера (Австрия) и П. Дирака (Англия), и разработанной на её основе современной квантовомеханической теории атома.
Представления квантовой механики о движении электрона (вообще микрочастицы) коренным образом отличаются от классических. Согласно квантовой механике, электрон не движется по траектории (орбите), подобно твёрдому шарику; движению электрона присущи также и некоторые особенности, характерные для распространения волн. С одной стороны, электрон всегда действует (например, при столкновениях) как единое целое, как частица, обладающая неделимым зарядом и массой; в то же время электроны с определённой энергией и импульсом распространяются подобно плоской волне, обладающей определённой частотой (и определённой длиной волны). Энергия электрона Е как частицы связана с частотой v электронной волны соотношением: E=hv, а его импульс р — с длиной волны l соотношением: р = h/l.
Устойчивые движения электрона в атоме, как показал Шрёдингер (1926), в некотором отношении аналогичны стоячим волнам, амплитуды которых в разных точках различны. При этом в атоме, как в колебательной системе, возможны лишь некоторые «избранные» движения с определёнными значениями энергии, момента количества движения и проекции момента электрона в атоме. Каждое стационарное состояние атома описывается при помощи некоторой волновой функции, являющейся решением волнового уравнения особого типа — уравнения Шрёдингера; волновой функции соответствует «электронное облако», характеризующее (в среднем) распределение плотности электронного заряда в атоме (см. Атом, там же на рис. 3 показаны проекции «электронных облаков» атома водорода). В 20—30-х гг. были разработаны приближённые методы расчёта распределения плотности электронного заряда в сложных атомах, в частности метод Томаса — Ферми (1926, 1928). Эта величина и связанное с ней значение т. н. атомного фактора важны при исследовании электронных столкновений с атомами, а также рассеяния ими рентгеновских лучей.
На основе квантовой механики удалось путём решения уравнения Шрёдингера правильно рассчитать энергии электронов в сложных атомах. Приближённые методы таких расчётов были разработаны в 1928 Д. Хартри (Англия) и в 1930 В. А. Фоком (СССР). Исследования атомных спектров полностью подтвердили квантовомеханическую теорию атома. При этом выяснилось, что состояние электрона в атоме существенно зависит от его спина — собственного механического момента количества движения. Было дано объяснение действия внешних электрических и магнитных полей на атом (см. Штарка явление, Зеемана явление). Важный общий принцип, связанный со спином электрона, был открыт швейцарским физиком В. Паули (1925) (см. Паули принцип), согласно этому принципу, в каждом электронном состоянии в атоме может находиться только один электрон; если данное состояние уже занято каким-либо электроном, то последующий электрон, входя в состав атома, вынужден занимать другое состояние. На основе принципа Паули были окончательно установлены числа заполнения электронных оболочек в сложных атомах, определяющие периодичность свойств элементов. Исходя из квантовой механики, немецкие физики В. Гейтлер и Ф. Лондон (1927) дали теорию т. н. гомеополярной химической связи двух одинаковых атомов (например, атомов водорода в молекуле H2), не объяснимой в рамках боровской модели атома.
Важными применениями квантовой механики в 30-х гг. ив дальнейшем были исследования связанных атомов, входящих в состав молекулы или кристалла. Состояния атома, являющегося частью молекулы, существенно отличаются от состояний свободного атома. Существенные изменения претерпевает атом также в кристалле под действием внутрикристаллического поля, теория которого была впервые разработана Х. Бете (1929). Исследуя эти изменения, можно установить характер взаимодействия атома с его окружением. Крупнейшим экспериментальным достижением в этой области Атомная физика было открытие Е. К. Завойским в 1944 электронного парамагнитного резонанса, давшего возможность изучать различные связи атомов с окружающей средой.
Современная атомная физика. Основными разделами современной Атомная физика являются теория атома, атомная (оптическая) спектроскопия, рентгеновская спектроскопия, радиоспектроскопия (она исследует также и вращательные уровни молекул), физика атомных и ионных столкновений. Различные разделы спектроскопии охватывают разные диапазоны частот излучения и, соответственно, разные диапазоны энергий квантов. В то время как рентгеновская спектроскопия изучает излучения атомов с энергиями квантов до сотен тыс. эв, радиоспектроскопия имеет дело с очень малыми квантами — вплоть до квантов менее 10-6 эв.
Важнейшая задача Атомная физика — детальное определение всех характеристик состояний атома. Речь идёт об определении возможных значений энергии атома — его уровней энергии, значений моментов количества движения и других величин, характеризующих состояния атома. Исследуются тонкая и сверхтонкая структуры уровней энергии (см. Атомные спектры), изменения уровней энергии под действием электрических и магнитного полей — как внешних, макроскопических, так и внутренних, микроскопических. Большое значение имеет такая характеристика состояний атома, как время жизни электрона на уровне энергии. Наконец, большое внимание уделяется механизму возбуждения атомных спектров.
Области явлений, исследуемых разными разделами Атомная физика, перекрываются. Рентгеновская спектроскопия измерением испускания и поглощения рентгеновских лучей позволяет определить главным образом энергии связи внутренних электронов с ядром атома (энергии ионизации), распределение электрического поля внутри атома. Оптическая спектроскопия изучает совокупности спектральных линий, испускаемых атомами, определяет характеристики уровней энергии атома, интенсивности спектральных линий и связанные с ними времена жизни атома в возбуждённых состояниях, тонкую структуру уровней энергии, их смещение и расщепление в электрическом и магнитном полях. Радиоспектроскопия детально исследует ширину и форму спектральных линий, их сверхтонкую структуру, сдвиг и расщепление в магнитном поле, вообще внутриатомные процессы, вызываемые очень слабыми взаимодействиями и влияниями среды.
Анализ результатов столкновений быстрых электронов и ионов с атомами даёт возможность получить сведения о распределении плотности электронного заряда («электронного облака») внутри атома, об энергиях возбуждения атома, энергиях ионизации.
Результаты детального исследования строения атомов находят самые широкие применения не только во многих разделах физики, но и в химии, астрофизике и других областях науки. На основании изучения уширения и сдвига спектральных линий можно судить о местных (локальных) полях в среде (жидкости, кристалле), обусловливающих эти изменения, и о состоянии этой среды (температуре, плотности и др.). Знание распределения плотности электронного заряда в атоме и её изменений при внешних взаимодействиях позволяет предсказать тип химических связей, которые может образовывать атом, поведение иона в кристаллической решётке. Сведения о структуре и характеристиках уровней энергии атомов и ионов чрезвычайно важны для устройств квантовой электроники. Поведение атомов и ионов при столкновениях — их ионизация, возбуждение, перезарядка — существенно для физики плазмы. Знание детальной структуры уровней энергии атомов, особенно многократно ионизованных, важно для астрофизики.
Таким образом, Атомная физика тесно связана с другими разделами физики и другими науками о природе. Представления об атоме, выработанные Атомная физика, имеют и важное мировоззренческое значение. «Устойчивость» атома объясняет устойчивость различных видов вещества, непревратимость химических элементов в естественных условиях, например при обычных на Земле температурах и давлениях. «Пластичность» же атома, изменение его свойств и состояний при изменении внешних условий, в которых он существует, объясняет возможность образования более сложных систем, качественно своеобразных, их способность приобретать различные формы внутренней организации. Так находит разрешение то противоречие между идеей о неизменных атомах и качественным многообразием веществ, которое существовало и в древности, и в новое время и служило основанием для критики атомизма.
Лит.: Бор Н., Три статьи о спектрах и строении атомов, пер. с нем., М.—П., 1923; Борн М., Современная физика, пер. с нем., М., 1965; Бройль Л., Революция в физике, пер. с франц., М., 1963; Шпольский Э. В., Атомная физика, 5 изд., т. 1, М., 1963.
М. А. Ельяшевич. Р. Я. Штейнман.
| "БСЭ" >> "А" >> "АТ" >> "АТО" |
Статья про "Атомная физика" в Большой Советской Энциклопедии была прочитана 1684 раз
| Пицца в сковороде |
| Луковый соус |
TOP 20
- Лемке Михаил Константинович
- Сульфгидрильные группы
- «Казарменный коммунизм»
- Японское море
- Периодическая система элементов
- Глициния
- Башкирская Автономная Советская Социалистическая Республика
- Иммунитет (историч.)
- Андаманское море
- Сенсуализм
- Объединённая партия гаитянских коммунистов
- «Сообразительный»
- Балкано-кавказская раса
- Навигация (морск.)
- Звёздная астрономия
- Ямполь (пос. гор. типа в Донецкой обл.)
- Мандельштама - Бриллюэна рассеяние
- Кульчицкая Елена Львовна
- Театральные учебные заведения
- Электрическая постоянная