


БНБ
"БСЭ" (95279)
- Photogallery
- Естественные науки - Математика - Технология
- Авиация и машиностроение
- Высокие технологии
- Вычислительная техника
- Нанотехнология
- Роботехника
- Энергетика
- Электроника
Железо
Определение "Железо" в Большой Советской Энциклопедии
 |
| Дверная ручка и дверная петля-жиковина. 17 в. |
 |
| Канделябр (Каталония) |
 |
| Катаев Л. П.и др. Памятник большевикам |
 |
| Решетка ограды дома Челлеси (Ареццо) |
 |
| Флюгер с Владимирской башни Китай-города |
 |
| Церковь Вознесения (Коломенское) |
 |
| Церковь Никиты Мученика |
 при 20°С). Между 910°С и 1400°С устойчива g-модификация с ГЦК-решёткой (а = 3,64
при 20°С). Между 910°С и 1400°С устойчива g-модификация с ГЦК-решёткой (а = 3,64  ). Выше 1400°С вновь образуется ОЦК-решётка d-Fe (а = 2,94
). Выше 1400°С вновь образуется ОЦК-решётка d-Fe (а = 2,94  ), устойчивая до температуры плавления (1539°С). a - Fe ферромагнитно вплоть до 769°С (точка Кюри). Модификация g-Fe и d-Fe парамагнитны.
), устойчивая до температуры плавления (1539°С). a - Fe ферромагнитно вплоть до 769°С (точка Кюри). Модификация g-Fe и d-Fe парамагнитны.
 |
| Цубы 14—16 вв. (Япония) |
 ), размещаются в междоузлиях кристаллической решётки металла, состоящей из более крупных атомов (атомный радиус Fe 1,26
), размещаются в междоузлиях кристаллической решётки металла, состоящей из более крупных атомов (атомный радиус Fe 1,26  ). Твёрдый раствор углерода в g-Fe наз. аустенитом, а в (a-Fe— ферритом. Насыщенный твёрдый раствор углерода в g- Fe содержит 2,0% С по массе при 1130°С; a-Fe растворяет всего 0,02— 0,04%С при 723°С, и менее 0,01% при комнатной температуре. Поэтому при закалке аустенита образуется мартенсит — пересыщенный твёрдый раствор углерода в a- Fe, очень твёрдый и хрупкий. Сочетание закалки с отпуском (нагревом до относительно низких температур для уменьшения внутренних напряжений) позволяет придать стали требуемое сочетание твёрдости и пластичности (см. Железо - углеродистые сплавы. Термическая обработка металлов).
). Твёрдый раствор углерода в g-Fe наз. аустенитом, а в (a-Fe— ферритом. Насыщенный твёрдый раствор углерода в g- Fe содержит 2,0% С по массе при 1130°С; a-Fe растворяет всего 0,02— 0,04%С при 723°С, и менее 0,01% при комнатной температуре. Поэтому при закалке аустенита образуется мартенсит — пересыщенный твёрдый раствор углерода в a- Fe, очень твёрдый и хрупкий. Сочетание закалки с отпуском (нагревом до относительно низких температур для уменьшения внутренних напряжений) позволяет придать стали требуемое сочетание твёрдости и пластичности (см. Железо - углеродистые сплавы. Термическая обработка металлов).
 |
| Шкатулка (Великий Устюг) |
Ниже приводятся физические свойства Железо, относящиеся в основном к металлу с общим содержанием примесей менее 0,01% по массе:
Атомный радиус 1,26
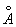
Ионные радиусы Fe2+O,80  , Fe3+O,67
, Fe3+O,67 
Плотность (20oC) 7,874 г/см3
tпл 1539°С
tkип около 3200оС
Температурный коэффициент линейного расширения (20°С) 11,7·10-6
Теплопроводность (25°С) 74,04 вт/(м·К)
[0,177 (кал/см·сек·град)]
Теплоёмкость Железо зависит от его структуры и сложным образом изменяется с температурой; средняя удельная теплоёмкость (0-1000oC) 640,57 дж/(кг·К) [0,153 кал/ (г·град)].
Удельное электрическое сопротивление (20°С)
9,7·10-8ом·м [9,7·10-6ом·см]
Температурный коэффициент электрического сопротивления
(0—100°С) 6,51·10-3
Модуль Юнга 190—210·103 Мн/м.2
(19-21·103кгс/мм2)
Температурный коэффициент модуля Юнга
4·10-6
Модуль сдвига 84,0·103 Мн/м2 [8,4·103кгс/мм2]
Кратковременная прочность на разрыв
170-210Мн/м2[17-21кгс/мм2]
Относительное удлинение 45—55%
Твёрдость по Бринеллю 350—450 Мн/м2
[35—45 кгс/мм2]
Предел текучести 100Мн/м2 [10 кгс/мм2]
Ударная вязкость 300 Мн/м2 [30 кгс/мм2]
Конфигурация внешней электронной оболочки атома Fe 3d64s2. Железо проявляет переменную валентность (наиболее устойчивы соединения 2- и 3-валентного Железо). С кислородом Железо образует закись FeO, окись Fe2O3 и закись-окись Fe3O4 (соединение FeO с Fe2O3, имеющее структуру шпинели). Во влажном воздухе при обычной температуре Железо покрывается рыхлой ржавчиной (Fe2O3·nH2O). Вследствие своей пористости ржавчина не препятствует доступу кислорода и влаги к металлу и поэтому не предохраняет его от дальнейшего окисления. В результате различных видов коррозии ежегодно теряются миллионы тонн Железо (см. Коррозия металлов). При нагревании Железо в сухом воздухе выше 200°С оно покрывается тончайшей окисной плёнкой, которая защищает металл от коррозии при обычных температурах; это лежит в основе технического метода защиты Железо — воронения. При нагревании в водяном паре Железо окисляется с образованием Fe3O4 (ниже 570°С) или FeO (выше 570°С) и выделением водорода.
Гидроокись Fe (OH)2 образуется в виде белого осадка при действии едких щелочей или аммиака на водные растворы солей Fe2+ в атмосфере водорода или азота. При соприкосновении с воздухом Fe (OH)2 сперва зеленеет, затем чернеет и наконец быстро переходит в красно-бурую гидроокись Fe (OH)3. Закись FeO проявляет основные свойства. Окись Fe2O3 амфотерна и обладает слабо выраженной кислотной функцией; реагируя с более основными окислами (например, с MgO), она образует ферриты — соединения типа Fe2O3·nMeO, имеющие ферромагнитные свойства и широко применяющиеся в радиоэлектронике. Кислотные свойства выражены и у 6-валентного Железо, существующего в виде ферратов, например K2FeO4, солей не выделенной в свободном состоянии железной кислоты.
Железо легко реагирует с галогенами и галогеноводородами, давая соли, например хлориды FeCl2 и FeCl3. При нагревании Железо с серой образуются сульфиды FeS и FeS2. Карбиды Железо — Fe3C (цементит) и Fe2C (e-карбид) — выпадают из твёрдых растворов углерода в Железо при охлаждении. Fe3C выделяется также из растворов углерода в жидком Железо при высоких концентрациях С. Азот, подобно углероду, даёт с Железо твёрдые растворы внедрения; из них выделяются нитриды Fe4N и Fe2N. С водородом Железо даёт лишь малоустойчивые гидриды, состав которых точно не установлен. При нагревании Железо энергично реагирует с кремнием и фосфором, образуя силициды (например, Fe3Si) и фосфиды (например, Fe3P).
Соединения Железо с многими элементами (О, S и др.), образующие кристаллическую структуру, имеют переменный состав (так, содержание серы в моносульфиде может колебаться от 50 до 53,3 ат.%). Это обусловлено дефектами кристаллической структуры. Например, в закиси Железо часть ионов Fe2+ в узлах решётки замещена ионами Fe3+; для сохранения электронейтральности некоторые узлы решётки, принадлежавшие ионам Fe2+, остаются пустыми и фаза (вюстит) в обычных условиях имеет формулу Fe0,947O.
Нормальный электродный потенциал Железо в водных растворах его солей для реакции
составляет — 0,44 в, а для реакции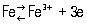
равен — 0,036 в. Т. о., в ряду активностей Железо стоит левее водорода. Оно легко растворяется в разбавленных кислотах с выделением H2 и образованием ионов Fe2+.
Своеобразно взаимодействие Железо с азотной кислотой. Концентрированная HNO3 (плотность 1,45 г/см3) пассивирует Железо вследствие возникновения на его поверхности защитной окисной плёнки; более разбавленная HNO3 растворяет Железо с образованием ионов Fe2+ или Fe3+, восстанавливаясь до MH3 или N2O и N2.
Растворы солей 2-валентного Железо на воздухе неустойчивы — Fe2+ постепенно окисляется до Fe3+. Водные растворы солей Железо вследствие гидролиза имеют кислую реакцию. Добавление к растворам солей Fe3+ тиоцианат-ионов SCN- даёт яркую кроваво-красную окраску вследствие возникновения Fe (SCN)3, что позволяет открывать присутствие 1 части Fe3+ примерно в 106 частях воды. Для Железо характерно образование комплексных соединений.
Получение и применение. Чистое Железо получают в относительно небольших количествах электролизом водных растворов его солей или восстановлением водородом его окислов. Разрабатывается способ непосредственного получения Железо из руд электролизом расплавов. Постепенно увеличивается производство достаточно чистого Железо путём его прямого восстановления из рудных концентратов водородом, природным газом или углём при относительно низких температурах.
Железо — важнейший металл современной техники. В чистом виде Железо из-за его низкой прочности практически не используется, хотя в быту «железными» часто называют стальные или чугунные изделия. Основная масса Железо применяется в виде весьма различных по составу и свойствам сплавов. На долю сплавов Железо приходится примерно 95% всей металлической продукции. Богатые углеродом сплавы (свыше 2% по массе) — чугуны, выплавляют в доменных печах из обогащенных железных руд (см. Доменное производство). Сталь различных марок (содержание углерода менее 2% по массе) выплавляют из чугуна в мартеновских и электрических печах и конвертерах путём окисления (выжигания) излишнего углерода, удаления вредных примесей (главным образом S, Р, О) и добавления легирующих элементов (см. Мартеновская печь, Конвертер). Высоколегированные стали (с большим содержанием никеля, хрома, вольфрама и др. элементов) выплавляют в электрических дуговых и индукционных печах. Для производства сталей и сплавов Железо особо ответственного назначения служат новые процессы — вакуумный, электрошлаковый переплав, плазменная и электронно-лучевая плавка и др. Разрабатываются способы выплавки стали в непрерывно действующих агрегатах, обеспечивающих высокое качество металла и автоматизацию процесса.
На основе Железо создаются материалы, способные выдерживать воздействие высоких и низких температур, вакуума и высоких давлений, агрессивных сред, больших переменных напряжений, ядерных излучений и т. п. Производство Железо и его сплавов постоянно растет. В 1971 в СССР выплавлено 89,3 млн. т чугуна и 121 млн. т стали.
Л. А. Шварцман, Л. В. Ванюкова.
Железо как художественный материал использовалось с древности в Египте (подставка для головы из гробницы Тутанхамона около Фив, середина 14 в. до н. э., Музей Ашмола, Оксфорд), Месопотамии (кинжалы, найденные около Кархемиша, 500 до н. э., Британский музей, Лондон), Индии (железная колонна в Дели, 415). Со времён средневековья сохранились многочисленные высокохудожественные изделия из Железо в странах Европы (Англии, Франции, Италии, России и др.) — кованые ограды, дверные петли, настенные кронштейны, флюгера, оковки сундуков, светцы. Кованые сквозные изделия из прутьев и изделия из просечного листового Железо (часто со слюдяной подкладкой) отличаются плоскостными формами, чётким линейно-графическим силуэтом и эффектно просматриваются на свето-воздушном фоне. В 20 в. Железо используется для изготовления решёток, оград, ажурных интерьерных перегородок, подсвечников, монументов.
Т. Л.
Железо в организме. Железо присутствует в организмах всех животных и в растениях (в среднем около 0,02%); оно необходимо главным образом для кислородного обмена и окислительных процессов. Существуют организмы (т. н. концентраторы), способные накапливать его в больших количествах (например, железобактерии — до 17—20% Железо). Почти всё Железо в организмах животных и растений связано с белками. Недостаток Железо вызывает задержку роста и явления хлороза растений, связанные с пониженным образованием хлорофилла. Вредное влияние на развитие растений оказывает и избыток Железо, вызывая, например, стерильность цветков риса и хлороз. В щелочных почвах образуются недоступные для усвоения корнями растений соединения Железо, и растения не получают его в достаточном количестве; в кислых почвах Железо переходит в растворимые соединения в избыточном количестве. При недостатке или избытке в почвах усвояемых соединений Железо заболевания растений могут наблюдаться на значительных территориях (см. Биогеохимические провинции).
В организм животных и человека Железо поступает с пищей (наиболее богаты им печень, мясо, яйца, бобовые, хлеб, крупы, шпинат, свёкла). В норме человек получает с рационом 60—110 мг Железо, что значительно превышает его суточную потребность. Всасывание поступившего с пищей Железо происходит в верхнем отделе тонких кишок, откуда оно в связанной с белками форме поступает в кровь и разносится с кровью к различным органам и тканям, где депонируется в виде Железо- белкового комплекса — ферритина. Основное депо Железо в организме — печень и селезёнка. За счёт Железо ферритина происходит синтез всех железосодержащих соединений организма: в костном мозге синтезируется дыхательный пигмент гемоглобин, в мышцах — миоглобин, в различных тканях цитохромы и др. железосодержащие ферменты. Выделяется Железо из организма главным образом через стенку толстых кишок (у человека около 6—10 мг в сутки) и в незначительной степени почками. Потребность организма в Железо меняется с возрастом и физическим состоянием. На 1 кг веса необходимо детям — 0,6, взрослым — 0,1 и беременным — 0,3 мг Железо в сутки. У животных потребность в Железо ориентировочно составляет (на 1 кг сухого вещества рациона): для дойных коров — не менее 50 мг, для молодняка — 30—50 мг, для поросят — до 200 мг, для супоросных свиней — 60 мг.
В. В. Ковальский.
В медицине лекарственные препараты Железо (восстановленное Железо, лактат Железо, глицерофосфат Железо, сульфат 2-валентного Железо, таблетки Бло, раствор яблочнокислого Железо, ферамид, гемостимулин и др.) используют при лечении заболеваний, сопровождающихся недостатком Железо в организме (железодефицитная анемия), а также как общеукрепляющие средства (после перенесённых инфекционных заболеваний и др.). Изотопы Железо (52Fe, 55Fe и 59Fe) применяют как индикаторы при медико-биологических исследованиях и диагностике заболеваний крови (анемии, лейкозы, полицитемия и др.).
Лит.: Общая металлургия, М., 1967; Некрасов Б. В., Основы общей химии, т. 3, М., 1970; Реми Г., Курс неорганической химии, пер. с нем., т. 2, М., 1966; Краткая химическая энциклопедия, т. 2, М., 1963; Левинсон Н. Р., [Изделия из цветного и чёрного металла], в кн.: Русское декоративное искусство, т. 1—3, М., 1962—65; Вернадский В. И., Биогеохимические очерки. 1922—1932, М. — Л., 1940; Граник С., Обмен железа у животных и растений, в сборнике: Микроэлементы, пер. с англ., М., 1962; Диксон М., Уэбб Ф., ферменты, пер. с англ., М., 1966; Neogi P., Iron in ancient India, Calcutta, 1914; Friend J. N., Iron in antiquity, L.,1926; Frank E. B., Old French ironwork, Camb. (Mass.), 1950; Lister R., Decorative wrought ironwork in Great Britain, L., 1960.
| "БСЭ" >> "Ж" >> "ЖЕ" >> "ЖЕЛ" >> "ЖЕЛЕ" |
Статья про "Железо" в Большой Советской Энциклопедии была прочитана 966 раз
| Коптим скумбрию в коробке |
| Стейк на сливочном масле |
TOP 20
- Лемке Михаил Константинович
- Сульфгидрильные группы
- «Казарменный коммунизм»
- Японское море
- Периодическая система элементов
- Глициния
- Башкирская Автономная Советская Социалистическая Республика
- Иммунитет (историч.)
- Объединённая партия гаитянских коммунистов
- Андаманское море
- Сенсуализм
- «Сообразительный»
- Балкано-кавказская раса
- Навигация (морск.)
- Звёздная астрономия
- Ямполь (пос. гор. типа в Донецкой обл.)
- Мандельштама - Бриллюэна рассеяние
- Кульчицкая Елена Львовна
- Театральные учебные заведения
- Электрическая постоянная