


БНБ
"БСЭ" (95279)
- Photogallery
- Естественные науки - Математика - Технология
- Авиация и машиностроение
- Высокие технологии
- Вычислительная техника
- Нанотехнология
- Роботехника
- Энергетика
- Электроника
Газы (агрегатное состояние вещества)
Определение "Газы (агрегатное состояние вещества)" в Большой Советской Энциклопедии
 |
| Диаграмма состояния вещества |
 |
| Распределение Максвела |
Любое вещество можно перевести в газообразное состояние надлежащим подбором давления и температуры. Поэтому возможную область существования газообразного состояния графически удобно изобразить в переменных: давление р — температура Т (в р, Т-диаграмме, рис. 1). При температурах ниже критической Тк (см. Критическое состояние) эта область ограничена кривыми сублимации (возгонки) / и парообразования II. Это означает, что при любом давлении ниже критического рк существует температура Т (см. рис. 1), определяемая кривой сублимации или парообразования, выше которой вещество становится газообразным. В состояниях на кривой 1 (ниже тройной точки Tp) газ находится в равновесии с твёрдым веществом (твёрдой фазой), а на кривой II (между тройной и критической точкой К.) — с жидкой фазой. Газ в этих состояниях обычно называют паром вещества.
При температурах ниже Тк можно сконденсировать Газы (агрегатное состояние вещества) — перевести его в др. агрегатное состояние (твёрдое или жидкое). При этом фазовое превращение Газы (агрегатное состояние вещества) в жидкость или твёрдое тело происходит скачкообразно: весьма малое изменение давления приводит к конечному изменению ряда свойств вещества (например, плотности, энтальпии, теплоёмкости и др.). Процессы конденсации Газы (агрегатное состояние вещества), особенно сжижение газов, имеют важное техническое значение.
При Т > Тк граница газообразной области условна, поскольку при этих температурах фазовые превращения не происходят. В ряде случаев за условную границу между Газы (агрегатное состояние вещества) и жидкостью при сверхкритических температурах и давлениях принимают критическую изохору вещества (кривую постоянной плотности или удельного объёма, см. рис. 1), в непосредственной близости от которой свойства вещества изменяются, хотя и не скачком, но особенно быстро.
В связи с тем что область газового состояния очень обширна, свойства Газы (агрегатное состояние вещества) при изменении температуры и давления могут меняться в широких пределах. Так, в нормальных условиях (при 0° С и атмосферном давлении) плотность Газы (агрегатное состояние вещества) примерно в 1000 раз меньше плотности того же вещества в твёрдом или жидком состоянии. При комнатной температуре, но давлении, в 1017 раз меньшем атмосферного (предел, достигнутый современной вакуумной техникой), плотность Газы (агрегатное состояние вещества) составляет около 10 -20 г/см3. В космических условиях плотность Газы (агрегатное состояние вещества) может быть ещё на 10 порядков меньше (~10-30/см3).
С другой стороны, при высоких давлениях вещество, которое при сверхкритических температурах можно считать Газы (агрегатное состояние вещества), обладает огромной плотностью (например, в центре некоторых звёзд ~109 г/см3). В зависимости от условий в широких пределах изменяются и др. свойства Газы (агрегатное состояние вещества) — теплопроводность, вязкость и т. д.
Молекулярно-кинетическая теория Газы (агрегатное состояние вещества) Молекулярно-кинетическая теория рассматривает Газы (агрегатное состояние вещества) как совокупность слабо взаимодействующих частиц (молекул или атомов), находящихся в непрерывном хаотическом (тепловом) движении. На основе этих простых представлений кинетической теории удаётся объяснить основные физические свойства Газы (агрегатное состояние вещества), особенно полно — свойства разреженных Газы (агрегатное состояние вещества)
У достаточно разреженных Газы (агрегатное состояние вещества) средние расстояния между молекулами оказываются значительно больше радиуса действия межмолекулярных сил. Так, например, при нормальных условиях в 1 см3 Газы (агрегатное состояние вещества) находится~ 1019 молекул и среднее расстояние между ними составляет ~ 10-6 см, или ~ 100 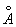 , тогда как межмолекулярное взаимодействие не существенно на расстояниях свыше 5—10
, тогда как межмолекулярное взаимодействие не существенно на расстояниях свыше 5—10 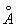 . Следовательно, в таких условиях молекулы взаимодействуют лишь при сближении на расстояние действия межмолекулярных сил. Такое сближение принято трактовать как столкновение молекул. Радиус действия межмолекулярных сил в рассмотренном примере в 10—20 раз меньше среднего расстояния между молекулами, так что общий объём, в котором эти силы могут сказываться (как бы «собственный объём» всех молекул), составляет 10-3—10-4 от полного объёма Газы (агрегатное состояние вещества) Это позволяет считать собственный объём молекул Газы (агрегатное состояние вещества) в нормальных условиях пренебрежимо малым и рассматривать молекулы как материальные точки. Газ, молекулы которого рассматриваются как не взаимодействующие друг с другом материальные точки, называется идеальным. При тепловом равновесии идеального Газы (агрегатное состояние вещества) все направления движения его молекул равновероятны, а скорости распределены в соответствии с Максвелла распределением. На рис. 2 приведён график этого распределения для азота при температурах 20 и 500°С. Из графика видно, что подавляющее большинство молекул имеет близкие значения скорости (максимум кривой соответствует скорости наиболее вероятной при данной температуре), но существует также известная часть молекул с малыми и очень большими скоростями. При помощи максвелловского распределения может быть определена т. н. средняя квадратичная скорость молекул
. Следовательно, в таких условиях молекулы взаимодействуют лишь при сближении на расстояние действия межмолекулярных сил. Такое сближение принято трактовать как столкновение молекул. Радиус действия межмолекулярных сил в рассмотренном примере в 10—20 раз меньше среднего расстояния между молекулами, так что общий объём, в котором эти силы могут сказываться (как бы «собственный объём» всех молекул), составляет 10-3—10-4 от полного объёма Газы (агрегатное состояние вещества) Это позволяет считать собственный объём молекул Газы (агрегатное состояние вещества) в нормальных условиях пренебрежимо малым и рассматривать молекулы как материальные точки. Газ, молекулы которого рассматриваются как не взаимодействующие друг с другом материальные точки, называется идеальным. При тепловом равновесии идеального Газы (агрегатное состояние вещества) все направления движения его молекул равновероятны, а скорости распределены в соответствии с Максвелла распределением. На рис. 2 приведён график этого распределения для азота при температурах 20 и 500°С. Из графика видно, что подавляющее большинство молекул имеет близкие значения скорости (максимум кривой соответствует скорости наиболее вероятной при данной температуре), но существует также известная часть молекул с малыми и очень большими скоростями. При помощи максвелловского распределения может быть определена т. н. средняя квадратичная скорость молекул 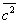 связанная с температурой Т газа соотношением
связанная с температурой Т газа соотношением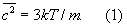
Здесь k — Больцмана постоянная, m — масса молекулы. Уравнение (1) позволяет установить связь между средней кинетической энергией одной молекулы и температурой газа: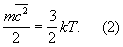
Эту зависимость часто рассматривают как молекулярно-кинетическое толкование температуры — температура есть мера кинетической энергии молекул.
Поскольку молекулы идеального Газы (агрегатное состояние вещества) обладают лишь кинетической энергией, внутренняя энергия такого Газы (агрегатное состояние вещества) не зависит от занимаемого им объёма (закон Джоуля).
Молекулярно-кинетическая теория рассматривает давление Газы (агрегатное состояние вещества) на стенки сосуда, в котором он находится, как воздействие ударов молекул, усреднённое по поверхности и времени. Количественно давление р определяется импульсом, передаваемым молекулами в единицу времени единице площади стенки: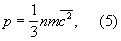
где n — число молекул в единице объёма. Уравнения (2) и (3) позволяют записать уравнение состояния идеального Газы (агрегатное состояние вещества) в виде
p = nkT. (4)
уравнение (4), записанное для 1 моля Газы (агрегатное состояние вещества), содержащего N = 6,023- 1023 молекул (см. Авогадро число), называют Клапейрона уравнением:
pv = RT. (5)
Здесь R = kN — универсальная газовая постоянная, v — объём, приходящийся на 1 моль. уравнение Клапейрона обобщает эмпирические газовые законы Бойля — Мариотта и Гей-Люссака (см. Бойля — Мариотта закон, Гей-Люссака законы). Из уравнения (5) следует также, что при одинаковых температуре и давлении идеальные Газы (агрегатное состояние вещества), взятые в количестве 1 моля, имеют равные объёмы и в любом таком Газы (агрегатное состояние вещества) в единице объёма содержится равное количество молекул (см. Авогадро закон).
В условиях теплового равновесия температура и давление Газы (агрегатное состояние вещества) по всему его объёму одинаковы, молекулы движутся хаотично, в Газы (агрегатное состояние вещества) нет упорядоченных потоков. Возникновение в Газы (агрегатное состояние вещества) перепадов (градиентов) температуры или давления приводит к нарушению равновесия и переносу в направлении градиента энергии, массы или др. физических величин.
Кинетические свойства Газы (агрегатное состояние вещества) — теплопроводность, диффузию, вязкость — молекулярно-кинетическая теория рассматривает с единой точки зрения: диффузию как перенос молекулами массы, теплопроводность как перенос ими энергии, вязкость как перенос количества движения. Модель идеального Газы (агрегатное состояние вещества) для анализа явлений переноса непригодна, ибо в этих процессах существенную роль играют столкновения молекул (при которых происходит передача какой-нибудь из переносимых величин, например энергии) и «размер» молекул (влияющий на частоту столкновений). Поэтому в простейшем случае явления переноса в Газы (агрегатное состояние вещества) рассматриваются для разреженного Газы (агрегатное состояние вещества), молекулы которого в первом приближении считаются упругими шариками с определённым диаметром s, причём эти шарики взаимодействуют друг с другом только в момент соударения. В этом приближении диаметр молекулы связан простым соотношением с её средней длиной свободного пробега 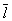 :
: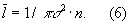
Размер 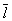 существенно влияет на процессы переноса в разреженном Газы (агрегатное состояние вещества) В частности, если характерный размер объёма, занимаемого Газы (агрегатное состояние вещества), больше
существенно влияет на процессы переноса в разреженном Газы (агрегатное состояние вещества) В частности, если характерный размер объёма, занимаемого Газы (агрегатное состояние вещества), больше 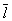 , то теплопроводность и вязкость Газы (агрегатное состояние вещества) не зависят от давления. Наоборот, когда
, то теплопроводность и вязкость Газы (агрегатное состояние вещества) не зависят от давления. Наоборот, когда 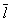 больше характерного размера, теплопроводность и вязкость Газы (агрегатное состояние вещества) с уменьшением давления (а значит, и числа столкновений) начинают падать. На этом явлении, в частности, основаны теплоизолирующие свойства сосудов с двойными стенками, воздух между которыми откачан (см. Дьюара сосуды).
больше характерного размера, теплопроводность и вязкость Газы (агрегатное состояние вещества) с уменьшением давления (а значит, и числа столкновений) начинают падать. На этом явлении, в частности, основаны теплоизолирующие свойства сосудов с двойными стенками, воздух между которыми откачан (см. Дьюара сосуды).
В более строгой молекулярной теории при анализе явлений переноса в разреженных газах учитывается взаимодействие молекул при любых расстояниях между ними. Характер взаимодействия определяется т. н. потенциалом взаимодействия (см. Межмолекулярное взаимодействие). Строгое рассмотрение динамики парных взаимодействий (столкновений) приводит к тому, что в формулах для расчёта коэффициентов переноса появляются т. н. интегралы столкновений, являющиеся функциями только приведённой температуры T* = kT/e. Эта температура характеризует отношение кинетической энергии молекул (~kT) к их потенциальной энергии (e — глубина потенциальной ямы при данном потенциале взаимодействия). Интегралы столкновений учитывают то обстоятельство, что сталкивающиеся молекулы в зависимости от их кинетической энергии, а значит и температуры Газы (агрегатное состояние вещества), могут сближаться на различные расстояния, т. е. как бы изменять свой эффективный размер.
Свойства реальных Г. При повышении плотности изменяются свойства Газы (агрегатное состояние вещества), они перестают быть идеальными. Уравнение состояния (5) оказывается неприменимым, т. к. средние расстояния между молекулами Газы (агрегатное состояние вещества) становятся сравнимыми с радиусом межмолекулярного взаимодействия. Для описания термодинамических свойств неидеальных, или, как их чаще называют, реальных, Газы (агрегатное состояние вещества) пользуются различными уравнениями состояния, имеющими более или менее строгое теоретическое обоснование. Простейшим примером уравнения, которое качественно правильно описывает основные отличия реального Газы (агрегатное состояние вещества) от идеального, служит уравнение Ван-дер-Ваальса. Оно учитывает, с одной стороны, существование сил притяжения между молекулами (их действие приводит к уменьшению давления Газы (агрегатное состояние вещества)), с другой стороны — сил отталкивания, препятствующих безграничному сжатию Газы (агрегатное состояние вещества) (см. Ван-дер-Ваальса уравнение).
К наиболее теоретически обоснованным, во всяком случае для состояний, удалённых от критической точки, относится вириальное уравнение состояния: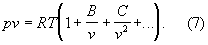
Значения вириальных коэффициентов В, С и т. д. определяются соударениями молекул: парными (В), тройными (С) и более высокого порядка для последующих коэффициентов. Существенно, что вириальные коэффициенты являются функциями только температуры.
В Газы (агрегатное состояние вещества) малой плотности наиболее вероятны парные столкновения молекул, т. е. для такого Газы (агрегатное состояние вещества) в разложении (7) можно пренебречь всеми членами после члена с коэффициента В. В соответствии с температурным изменением В, при т. н. температуре Бойля ТВ (см. Бойля точка) В обращается в нуль, и умеренно плотный Газы (агрегатное состояние вещества) ведёт себя как идеальный, т. е. подчиняется уравнению (5). Физически это означает, что при ТВ межмолекулярные силы притяжения и отталкивания практически компенсируют друг друга. Существование межмолекулярного взаимодействия в той или иной степени сказывается на всех свойствах реальных Газы (агрегатное состояние вещества) Внутренняя энергия реального Газы (агрегатное состояние вещества) оказывается зависящей от его объёма (от расстояний между молекулами), т. к. потенциальная энергия молекул определяется их взаимными расстояниями.
С межмолекулярным взаимодействие связано также изменение температуры реального Газы (агрегатное состояние вещества) при протекании его с мало постоянной скоростью через пористую перегородку (этот процесс называется дросселированием). Мерой изменения температуры Г при дросселировании служит Джоуля — Томсона коэффициент который в зависимости от условий может быть положительным (охлаждение Газы (агрегатное состояние вещества)), отрицательным (нагрев Газы (агрегатное состояние вещества)) либо равным нулю при т. н. температуре инверсии (см. Джоуля — Томсона явление). Эффект охлаждения Г при дросселировании широко применяется в технике как один из методов сжижения газов.
Внутреннее строение молекул Газы (агрегатное состояние вещества) слабо влияет на их термические свойства (давление, температуру, плотность и связь между ними). Для этих свойств в первом приближении существенна только молекулярная масса Газы (агрегатное состояние вещества) Напротив, калорические свойства Газы (агрегатное состояние вещества) (теплоёмкость, энтропия и др.), а также его электрические и магнитные свойства существенно зависят от внутреннего строения молекул. Например, для расчёта (в первом приближении) теплоёмкости Газы (агрегатное состояние вещества) при постоянном объёме cv необходимо знать число внутренних степеней свободы молекулы (т. е. число возможных внутренних движений) iвн. В соответствии с равнораспределения законом классической статистической физики на каждую степень свободы молекулы Газы (агрегатное состояние вещества) (поступательную, колебательную, вращательную) приходится энергия, равная 1/2 · kT. Отсюда теплоёмкость 1 моля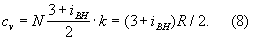
Для точного расчёта калорических свойств Газы (агрегатное состояние вещества) необходимо знать уровни энергии молекулы, сведения о которых в большинстве случаев получают из анализа спектров Газы (агрегатное состояние вещества) Для большого числа веществ в состоянии идеального Газы (агрегатное состояние вещества) калорические свойства вычислены с высокой точностью и их значения представлены в виде таблиц до температур 10—22 тыс. градусов.
Электрические свойства Газы (агрегатное состояние вещества) связаны в первую очередь с возможностью ионизации молекул или атомов, т. е. с появлением в Газы (агрегатное состояние вещества) электрически заряженных частиц (ионов и электронов). При отсутствии заряженных частиц Газы (агрегатное состояние вещества) являются хорошими диэлектриками. С ростом концентрации зарядов электропроводность Газы (агрегатное состояние вещества) увеличивается. Зависимость электропроводности Газы (агрегатное состояние вещества) от различных физических факторов рассмотрена в ст. Электрический разряд в газах.
При температурах начиная с нескольких тыс. градусов всякий Газы (агрегатное состояние вещества) частично ионизуется и превращается в плазму. Если концентрация зарядов в плазме невелика, то свойства её мало отличаются от свойств обычного Газы (агрегатное состояние вещества)
По магнитным свойствам Газы (агрегатное состояние вещества) делятся на диамагнитные (к ним относятся, например, инертные газы, H2, N2, CO2, H2O) и парамагнитные (например, O2). Диамагнитны те Газы (агрегатное состояние вещества), молекулы которых не имеют постоянного магнитного момента и приобретают его лишь под влиянием внешнего поля (см. Диамагнетизм). Те же Газы (агрегатное состояние вещества), у которых молекулы обладают постоянным магнитным моментом, во внешнем магнитном поле ведут себя как парамагнетики (см. Парамагнетизм). Учёт межмолекулярного взаимодействия и внутреннего строения молекул необходим при решении многих проблем физики Газы (агрегатное состояние вещества), например при исследовании влияния верхних разреженных слоев атмосферы на движение ракет и спутников (см. Газовая динамика, Аэродинамика разреженных газов).
В современной физике Газы (агрегатное состояние вещества) называют не только одно из агрегатных состояний вещества. К Газы (агрегатное состояние вещества) с особыми свойствами относят, например, совокупность свободных электронов в металле (электронный Газы (агрегатное состояние вещества)), фононов в жидком гелии (фононный Газы (агрегатное состояние вещества)) и т. д. Газы (агрегатное состояние вещества) элементарных частиц и квазичастиц обладающих целым спином, т. н. бозонов (например, фотонов, p-мезонов, фононов), называется бозе-газом. Его свойства рассматривает квантовая статистика Бозе — Эйнштейна. Свойства частиц Газы (агрегатное состояние вещества) с полуцелым спином — фермионов (например, электронов, нейтронов, нейтрино, дырок проводимости и др.) рассматривает квантовая статистика Ферми — Дирака (см. Статистическая физика).
Физические свойства газов<
| Свойства газов | Азот N2 | Аргон Ar | Водород H2 | Воздух | Кислород O2 | Углекислый газ CO2 |
| Масса 1 моля (г) | 28,02 | 39,94 | 2,016 | 28,96 | 32,00 | 44,00 |
| Плотность при 0°C и 1 ат* (кг/м3) | 1,2506 | 1,7839 | 0,0899 | 1,2928 | 1,4290 | 1,976 |
| Теплоемкость при постоянном объеме сv и 0°C (кдж/моль•град) | 20,85 | 12,48 | 20,35 | 20,81 | 20,89 | 30,62 (55°C) |
| Скорость звука при 0°C (м/сек) | 333,6 | 319 | 1286 | 331,5 | 314,8 | 260,3 |
| Вязкость h при 0°C (h•106 н•сек /м2) | 16,6 | 21,2 | 8,4 | 17,1 | 19,2 | 13,8 |
| Теплопроводность l при 0°C (l•102 дж/м•сек•град) | 2,43 | 1,62 | 16,84 | 2,41 | 2,44 | 1,45 |
| Диэлектрическая проницаемость e при 0°C и 1 ат* | 1,000588 | 1,000536 | 1,000272 | 1,000590 | 1,000531 | 1,000988 |
| Удельная магнитная восприимчивость c при 20°C (c•106 на 1 г) | -0,43 | -0,49 | -1,99 | — | +107,8 | 0,48 |
Лит.: Кириллин В. А., Сычев В. В. и Шейндлин А. Е., Техническая термодинамика, М., 1969; Кикоин И. К. и Кикоин А. К., Молекулярная физика, М., 1963; Гиршфельдер Дж., Кертисс Ч., Берд Р., Молекулярная теория газов и жидкостей, пер. с англ., М., 1961; Термодинамические свойства индивидуальных веществ. Справочник, под ред. В. П. Глушко, 2 изд., т. 1—2, М., 1962.
Э. Э. Шпильрейн.
I) и парообразования (II). Тр — тройная точка, К — критическая точка. Штриховой линией показана критическая изохора вещества." href="/a_pictures/18/10/236400118.jpg">I) и парообразования (II). Тр — тройная точка, К — критическая точка. Штриховой линией показана критическая изохора вещества."http://iodine.atomistry.com/">I) и парообразования (II). Тр — тройная точка, К — критическая точка. Штриховой линией показана критическая изохора вещества." src="a_pictures/18/10/th_236400118.jpg">
Рис. 1. р, Т-диаграмма состояния вещества. Область газообразного состояния заштрихована. Со стороны низких температур и давлений она ограничена кривыми сублимации (I) и парообразования (II). Тр — тройная точка, К — критическая точка. Штриховой линией показана критическая изохора вещества.
| "БСЭ" >> "Г" >> "ГА" >> "ГАЗ" >> "ГАЗЫ" |
Статья про "Газы (агрегатное состояние вещества)" в Большой Советской Энциклопедии была прочитана 1110 раз
| Бургер двойного помола |
| Морской Гребешок в беконе |
TOP 20
- Лемке Михаил Константинович
- Сульфгидрильные группы
- «Казарменный коммунизм»
- Японское море
- Периодическая система элементов
- Глициния
- Башкирская Автономная Советская Социалистическая Республика
- Иммунитет (историч.)
- Андаманское море
- Сенсуализм
- Объединённая партия гаитянских коммунистов
- «Сообразительный»
- Балкано-кавказская раса
- Навигация (морск.)
- Звёздная астрономия
- Ямполь (пос. гор. типа в Донецкой обл.)
- Мандельштама - Бриллюэна рассеяние
- Кульчицкая Елена Львовна
- Театральные учебные заведения
- Электрическая постоянная