


БНБ
"БСЭ" (95279)
- Photogallery
- Естественные науки - Математика - Технология
- Авиация и машиностроение
- Высокие технологии
- Вычислительная техника
- Нанотехнология
- Роботехника
- Энергетика
- Электроника
Белки (протеины)
Определение "Белки (протеины)" в Большой Советской Энциклопедии
 |
| Биосинтез белков (схема) |
 |
| Модель молекулы миоглобина |
 |
| Соединение аминокислот (схема) |
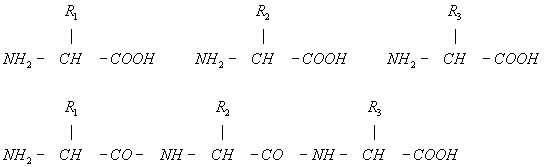
 |
| Трёхмерная структура фермента лизоцима (схема) |
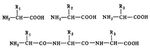
Кроме пептидных и дисульфидных связей, в молекуле Белки (протеины) есть многочисленные связи с меньшей энергией взаимодействия, имеющие большое значение для внутренней организации и функции Белки (протеины) Среди этих связей наиболее существенны так называемые гидрофобные связи, создаваемые неполярными боковыми группами аминокислот. Эти группы, лишённые сродства к воде, имеют тенденцию контактировать между собой внутри молекулы Белки (протеины) Кроме того, в молекуле Белки (протеины) имеются водородные связи, образуемые полярными группами, например —СО—NH—, а также электростатические взаимодействия между группами, несущими электрические заряды.
Пространственная конфигурация (конформация) полипептидной цепи Белки (протеины) определяется его первичной структурой и условиями среды. При обычных условиях (температура не выше 40°С, нормальное давление и т.д.) Белки (протеины) характеризуются внутримолекулярной упорядоченностью. «Хребет» полипептидной цепи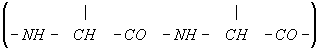
местами может закручиваться спиралью или образовывать полностью вытянутые отрезки (вторичная структура). В обоих случаях возникает система водородных связей. Но в значительной части «хребта» геометрическая регулярность может отсутствовать. Полипептидная цепь в целом «упаковывается» и жестко фиксируется с помощью взаимодействий боковых групп аминокислот (третичная структура). В зависимости от укладки полипептидных цепей форма молекул Белки (протеины) варьирует от фибриллярной (вытянутой, нитеобразной) до глобулярной (округлой). Детальная конфигурация глобулярных молекул сложна и своеобразна для каждого Белки (протеины) В молекуле превалирует совершенная упорядоченность, распространяющаяся на положение отдельных атомов. Однако некоторые периферические участки могут быть закреплены менее жестко, а погруженные в растворитель гидрофильные боковые группы остаются вполне гибкими. Конформация некоторых Белки (протеины), например лизоцима (рис. 2), раскрыта рентгеноструктурными исследованиями. Создание упорядоченной прочной конформации Белки (протеины) определяется целыми системами взаимодействий, находящихся во взаимной зависимости. Смены конформации Белки (протеины), вызываемые изменениями среды или реакциями, в которые Белки (протеины) вступают, связаны с изменением ряда взаимодействий. Конформационные переходы охватывают молекулу Белки (протеины) целиком или ограничиваются определёнными районами. При нагревании, резком подкислении среды и других сильных воздействиях происходит «плавление» молекулы Белки (протеины) — переход в состояние беспорядочного клубка. Это, как правило, влечёт за собой ряд других превращений, общий результат которых обозначают как денатурацию Белки (протеины) (см. Биополимеры). При этом понижается растворимость Белки (протеины), усиливается вязкость их растворов, теряются ферментативные и другие биологические свойства.
Каждый из бесчисленного множества существующих Белки (протеины) имеет особую наследственно детерминированную первичную структуру, присущую только ему. Это обусловливает строго индивидуальную систему внутримолекулярных связей, т. е. уникальную конформацию Белки (протеины) Поэтому каждый Белки (протеины) характеризуется собственной «химической топографией» и своеобразными сочетаниями пространственно сближенных химических групп. Часть таких сочетаний служит функциональными центрами молекул Белки (протеины) Благодаря структурному соответствию, напоминающему отношение ключа к замку (комплементарности), функциональные центры «узнают» и избирательно присоединяют вещества, на которые соответствующие Белки (протеины) «установлены». Функциональные — активные центры Белки (протеины)-ферментов специфически присоединяют субстраты и активируют их, ускоряя и направляя химические превращения. При помощи особых центров взаимного связывания («контактных площадок») определённые Белки (протеины) соединяются по нескольку вместе (структура 4-го порядка) или создают значительно более сложные системы (самосборка крупных белковых структур). Процессы самосборки существенны для морфогенеза.
Изучение структуры Белки (протеины) даёт возможность переходить к их синтезу. В 1955 была выяснена структура инсулина, молекула которого состоит из двух сравнительно коротких полипептидных цепей (21 и 30 аминокислотных остатков). Вслед за этим была раскрыта первичная структура гемоглобина, рибонуклеазы, трипсина и ряда других Белки (протеины) (рис. 3). Путём химического синтеза сначала были получены сложные пептиды со свойствами гормонов, затем удалось синтезировать гормон инсулин, наконец — фермент рибонуклеазу. Правильность химической формулы инсулина и рибонуклеазы подтвердилась тем, что синтетические Белки (протеины) не отличались от Белки (протеины), продуцируемых организмом, ни по физико-химическим свойствам, ни по биологической активности. Установлена полностью или частично первичная структура свыше 200 Белки (протеины)
Классификация Белки (протеины) До сих пор нет единого принципа классификации Белки (протеины) При делении всех известных Белки (протеины) на группы учитывают и их состав (строение), физико-химические свойства (растворимость, щёлочность), происхождение и роль в организме. Белки (протеины) делят на простые — протеины, состоящие только из аминокислот, и сложные — протеиды, в состав молекулы которых входят, кроме аминокислот, и другие соединения. К простым Белки (протеины) относятся альбумины, глобулины, гистоны, глутелины, проламины, протамины и протеиноиды. К сложным Белки (протеины) относятся гликопротеиды (содержащие, кроме аминокислот, углеводы), липопротеиды (содержащие липиды), нуклеопротеиды (в их состав входят и нуклеиновые кислоты), фосфопротеиды (содержащие фосфорные кислоты) и хромопротеиды (имеющие пигментные металлосодержащие группы).
В. А. Белицер.
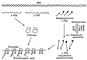
Биосинтез Белки (протеины) — процесс образования Белки (протеины) из аминокислот в клетках живых организмов. Выяснение механизма этого процесса, имеющего огромное биологическое значение, можно отнести к важнейшим достижениям науки 20 в. Биосинтез Белки (протеины) идёт при помощи особых сложных механизмов, обеспечивающих упорядоченное воспроизведение специфических Белки (протеины) уникальной структуры. Механизмы эти едины или весьма сходны для самых разнообразных клеток и организмов, в них принимают участие нуклеиновые кислоты, в особенности рибонуклеиновые кислоты (РНК). Этот процесс идёт с использованием энергии, накопленной в виде аденозинтрифосфорной кислоты (АТФ) (см. Биоэнергетика).
Биосинтез Белки (протеины) происходит на особых рибонуклеопротеидных частицах — рибосомах, состоящих из почти равных количеств рибосомной РНК (р-РНК) и белков. Первичная структура (последовательность аминокислот) синтезирующихся полипептидных цепочек обеспечивается соединением с рибосомами особой матричной, или информационной, рибонуклеиновой кислоты (и-РНК, или м-РНК), которая содержит информацию о специфическом строении Белки (протеины), «закодированную» в виде последовательного расположения нуклеотидов, составляющих и-РНК. Эту информацию и-РНК получает от дезоксирибонуклеиновой кислоты (ДНК), хранящей и передающей её по наследству. Аминокислоты, прежде чем попасть в рибосомы, активируются, получая энергию от АТФ и образуя соединение с адениловой кислотой. (Активированные аминокислоты представляют собой смешанный ангидрид аминокислоты и адениловой кислоты — аминоациладенилат.) Далее, остаток данной аминокислоты переносится на соответствующую транспортную рибонуклеиновую кислоту (т-РНК). Оба эти процесса катализируются одним и тем же ферментом (аминоациладенилатсинтетазой, или аминоацилт-РНК-синтетазой), специфическим для каждой аминокислоты. Определённой аминокислоте соответствуют одна или несколько специфичных для неё т-РНК. Все т-РНК сравнительно низкополимерны, содержат около 80 нуклеотидных остатков. Они построены по общему плану: в начале цепи находится 5-гуаниловая кислота, а в конце — часто обменивающаяся группировка из двух остатков цитидиловой кислоты и аденозина, к которому и присоединяется остаток аминокислоты. Остаток аминокислоты, соединённый с т-РНК, далее переносится на рибосомы, где и происходит образование полипептидной цепочки Белки (протеины) (рис. 4). Т. о., рибосомная стадия — центральный этап биосинтеза Белки (протеины) В процессе биосинтеза Белки (протеины) рибосомы соединяются в цепочки при помощи и-РНК, образуя активные белоксинтезирующие структуры —полирибосомы, или полисомы.
и-РНК синтезируется на матрице ДНК. В уникальной последовательности нуклеотидов ДНК линейно «записана» генетическая информация о последовательности аминокислотных остатков в полипептидных цепочках Белки (протеины)
В новообразованной и-РНК получается нуклеотидная последовательность, соответствующая матричной ДНК, — комплементарная последовательность, которая определяет первичную структуру синтезирующейся полипептидной цепочки. Включение каждой аминокислоты обусловливается (кодируется) определёнными группами из трёх нуклеотидных остатков (триплетами). Каждой аминокислоте соответствует несколько триплетов, или кодонов, для которых теперь установлены состав и последовательность нуклеотидов (см. Генетический код).
В полисомах т-РНК, нагруженная аминокислотой, присоединяется к соответствующим кодонам и-РНК. Это присоединение совершается внутри рибосомы в силу взаимодействия комплементарных оснований: аденина с урацилом или тимином и гуанина с цитозином. При этом т-РНК присоединяется к кодону содержащимся в ней комплементарным триплетом, называемым антикодоном. По мере продвижения рибосомы по нуклеотидной цепочке и-РНК к соседним кодонам присоединяются новые молекулы т-РНК, нагруженные аминокислотами. Предыдущая т-РНК при этом освобождается, присоединяя свою аминокислоту карбоксильным концом к аминогруппе новой аминокислоты с образованием пептидной связи. Т. о., полипептидная цепочка растет по мере продвижения рибосомы по и-РНК и освобождается по завершении своего синтеза, пройдя соответствующий участок и-РНК, комплементарный данному структурному гену (цистрону) ДНК.
Процесс биосинтеза Белки (протеины) не исчерпывается образованием полипептидных цепочек, т. е. созданием первичной структуры Белки (протеины) Далее происходит свёртывание цепочек в спирали, их «укладка» и взаимодействие, и образование вторичной, третичной и, иногда, четвертичной структуры. Однако возможно, что приведённая схема не исчерпывает всех путей биосинтеза Белки (протеины)
Весьма важна проблема регуляции биосинтеза Белки (протеины), определяющей включение или выключение синтеза тех или иных Белки (протеины) под влиянием внутренних (в том числе дифференцировки клеток и тканей) или внешних импульсов и создающей условия для синтеза Белки (протеины) в данной дифференцированной клетке.
Теоретическая и экспериментальная разработка проблемы биосинтеза Белки (протеины) имеет не только важнейшее теоретическое, но и практическое значение, поскольку, открывая подходы к воздействию на этот процесс, она намечает пути лечения ряда заболеваний, а также влияния на продуктивность многих сельскохозяйственных растений и животных.
В связи с важным значением Белки (протеины) разрабатываются новые методы получения Белки (протеины) и аминокислот путём промышленного микробиологического синтеза, т. е. выращиванием микробов (например, дрожжей и др.) на дешёвом сырье (например, нефти, газе и др.).
И. Белки (протеины) Збарский.
Лит.: Волькенштейн М. В., Молекулы и жизнь, М., 1965, гл. 3—5; Гауровиц Ф., Химия и функции белков, пер. с англ., [2 изд.], М., 1965; Биосинтез белка и нуклеиновых кислот, под ред. А. С. Спирина, М., 1965; Сисакян Н. М. и Гладилин К. Л., Биохимические аспекты синтеза белка, в кн.: Успехи биологической химии, т. 7, М., 1965, с. 3; Молекулы и клетки. [Сб. ст.], пер. с англ., М., 1966, с. 7—27, 94—106; Шамин А. Н., Развитие химии белка, М., 1966; Введение в молекулярную биологию, пер. с англ., М., 1967.
| "БСЭ" >> "Б" >> "БЕ" >> "БЕЛ" >> "БЕЛК" |
Статья про "Белки (протеины)" в Большой Советской Энциклопедии была прочитана 1538 раз
| Бургер двойного помола |
| Куриный суп |
TOP 20
- Лемке Михаил Константинович
- Сульфгидрильные группы
- «Казарменный коммунизм»
- Японское море
- Периодическая система элементов
- Объединённая партия гаитянских коммунистов
- Глициния
- Башкирская Автономная Советская Социалистическая Республика
- Иммунитет (историч.)
- Андаманское море
- Сенсуализм
- Балкано-кавказская раса
- «Сообразительный»
- Навигация (морск.)
- Звёздная астрономия
- Ямполь (пос. гор. типа в Донецкой обл.)
- Мандельштама - Бриллюэна рассеяние
- Кульчицкая Елена Львовна
- Театральные учебные заведения
- Электрическая постоянная